以下文章来源于细胞基因治疗前沿 ,作者玥
声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
近日,CDE官网公示显示,华夏英泰(北京)生物技术有限公司(简称“华夏英泰”)提交的HXYT-001细胞注射液获得一项临床试验默示许可,拟开发用于治疗复发/难治 B 细胞非霍奇金淋巴瘤(B-NHL), 包括弥漫大 B 细胞淋巴瘤、原发纵膈大 B 细胞淋巴瘤、滤泡性淋巴瘤转化的弥漫大 B 细胞淋巴瘤、 滤泡性淋巴瘤 3b 级、高级别 B 细胞淋巴瘤伴 MYC 和 BCL2 和/或 BCL6 重排和高级别 B 细胞淋巴瘤-非特指型。

HXYT-001细胞注射液是由华夏英泰基于与清华大学联合开发的全球首创合成性 T 细胞受体和抗原受体(STAR)修饰的T细胞(STAR-T)技术开发,采用人源化抗体靶向CD19和CD20的细胞治疗创新药物,也是华夏英泰首个获批IND的候选创新药。
此前,华夏英泰CD19/20 STAR-T的早期探索性临床研究数据已在2021年6月的第26届欧洲血液学协会(EHA)年会上公布,显示出良好的安全性和有效性。其中8例难治/复发(R/R) 急性B淋巴细胞白血病(R/R B-ALL)患者,成功接受CD19/CD20 STAR-T细胞输注并完成随访,均可在第14天快速实现微小残留疾病(MRD)阴性的完全缓解(CR),ORR达到100%,均无3级及以上CRS及ICANS。
华夏英泰首席执行官潘国华博士表示:“HXYT-001是公司创新型STAR-T技术平台的重要候选创新药,此次被NMPA临床试验默示许可,是我们的一项重大里程碑。我们将和国内的临床试验机构以及监管机构协作,积极推动该项目的临床试验进程。”

华夏英泰于2018年3月成立,是清华大学创新科研成果实施应用和顶尖人才推动北京医药健康产业创新发展的典型范例。公司专注于以TCR-T为代表的针对多种疾病的细胞免疫治疗产品的开发及商业化,拥有STAR-T和enTCR-T两大独有技术平台。目前已与北京大学肿瘤医院、北京大学人民医院、陆道培血液医院等多家一流医院合作启动了多项“First-in-Human”临床研究,取得了积极的临床安全性与有效性数据。
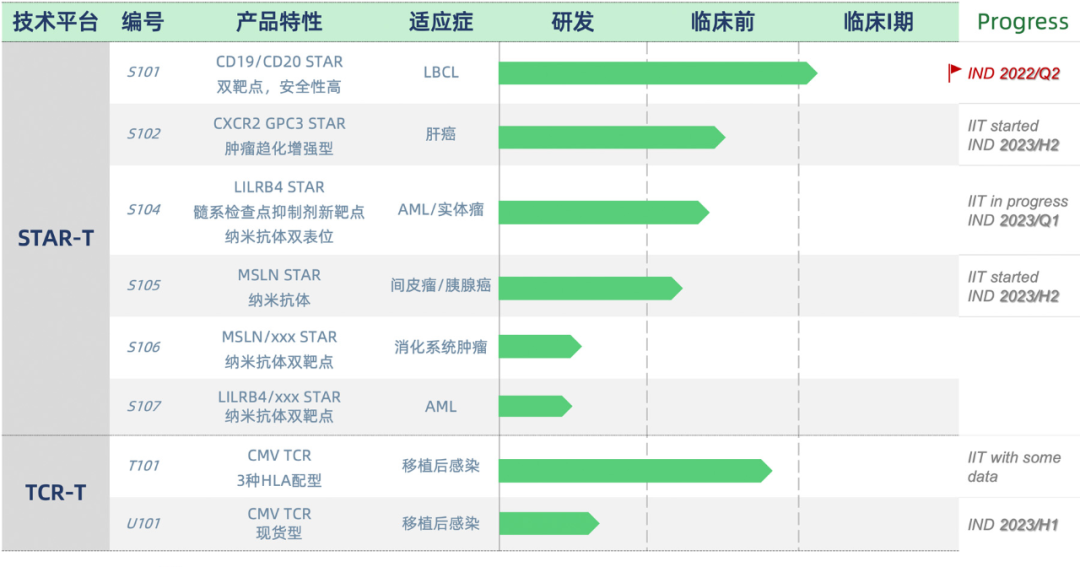
研发管线
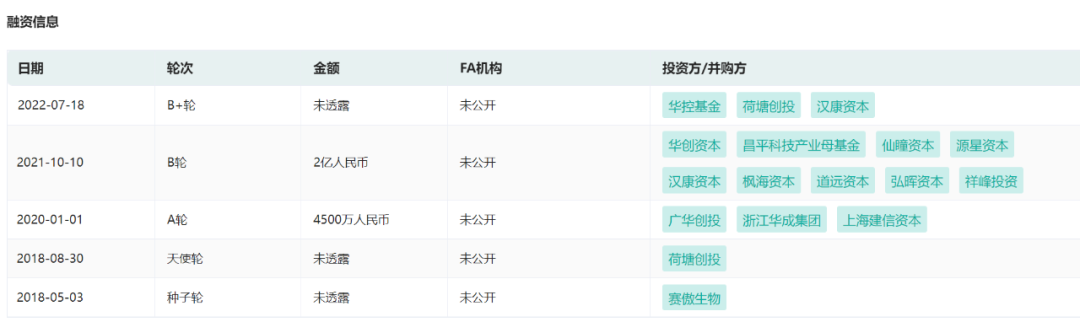
据药融云数据库可见,该公司已完成5次融资,其中B轮和B+轮已完成超过3亿元融资。
信息参考:
https://www.cn-immunotech.com/index.html




 药选址
药选址


