特斯拉的马斯克说:“医学的未来是mRNA,基本上你可以使用mRNA治愈一切”。沉寂数十载,一朝声名大噪。新冠疫情的到来让一直“寂寂无名”的mRNA技术崭露头角,实现了从实验室到临床的突破。mRNA疫苗作为一种特殊的药物,通过在人体内表达目标蛋白起到特定效应,以应用在肿瘤疫苗、基因编辑、CAR-T细胞治疗、蛋白替代疗法及其他传染病预防性疫苗领域。

图1 mRNA诱导的细胞和体液免疫反应[1]
翻译效率和免疫原性是mRNA行使功能的两大关键因素。自体免疫蛋白如RIGI和IFIT识别异常加帽的mRNA,降低了外源mRNA在细胞内的活性和半衰期,使得mRNA药物/疫苗在体内难以发挥作用。因此,优化mRNA帽结构(加帽)对于提高mRNA疫苗的生物活性和降低免疫原性是至关重要的。
IVT核心技术壁垒——“加帽”
mRNA“加帽”技术,即对mRNA的5'端帽子结构修饰技术。在真核细胞中,成熟的mRNA具备一些关键的结构元件来发挥相关的功能,而体外转录的mRNA,则是通过模拟内源性mRNA的结构来发挥作用。成熟mRNA的结构主要有五个部分,从5'到3'包括:5'帽子结构(5'Cap)、5'非翻译区(5'UTR)、编码蛋白的开放阅读框、3'非翻译区(3'UTR)和一个PolyA尾。

图2:mRNA结构式[2]
真核生物mRNA的5’端通常具有桥接的7-甲基鸟苷(m7G)帽子结构(Cap0),Cap0结构中m7G后面第一个核苷的2'羟基甲基化后形成Cap1结构(m7GpppmN)。现有研究发现,5'端帽子结构可以调节mRNA的剪切成熟,并帮助RNA转录产物穿过核膜的选择性孔道而进入细胞质。此外,5'帽子结构还可以保护mRNA不被核酸外切酶降解,与翻译起始因子蛋白协同工作,招募核糖体,并协助核糖体与mRNA结合,使翻译从AUG开始。通常情况下,Cap结构可以与真核起始因子4E(eIF4E)在翻译起始阶段相互识别,开启后续翻译过程,同时Cap1结构能够极大降低mRNA在体内的免疫原性。
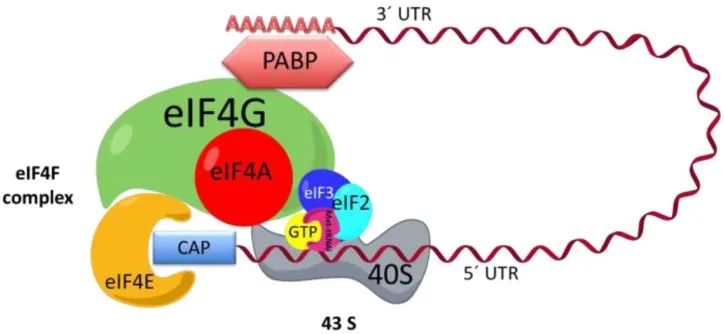
图3:mRNA起始蛋白翻译机制[3]
在体外转录制备mRNA有不同的“加帽”方法,包括酶加帽、共转录加帽等。酶法加帽是较为传统的加帽方式,该方法需在T7聚合酶参与的IVT反应结束后,先纯化获得未加帽的mRNA,再通过牛痘病毒加帽酶(兼具RNA三磷酸酯酶活性、鸟苷酰基转移酶活性和鸟嘌呤甲基转移酶活性)产生Cap0,再通过2’-O-甲基转移酶和S-腺苷甲硫氨酸转化为Cap1,再次纯化获得最终的mRNA。该过程使总体工艺步骤变得复杂、引入更多的杂质,增加了QA/QC质检项。
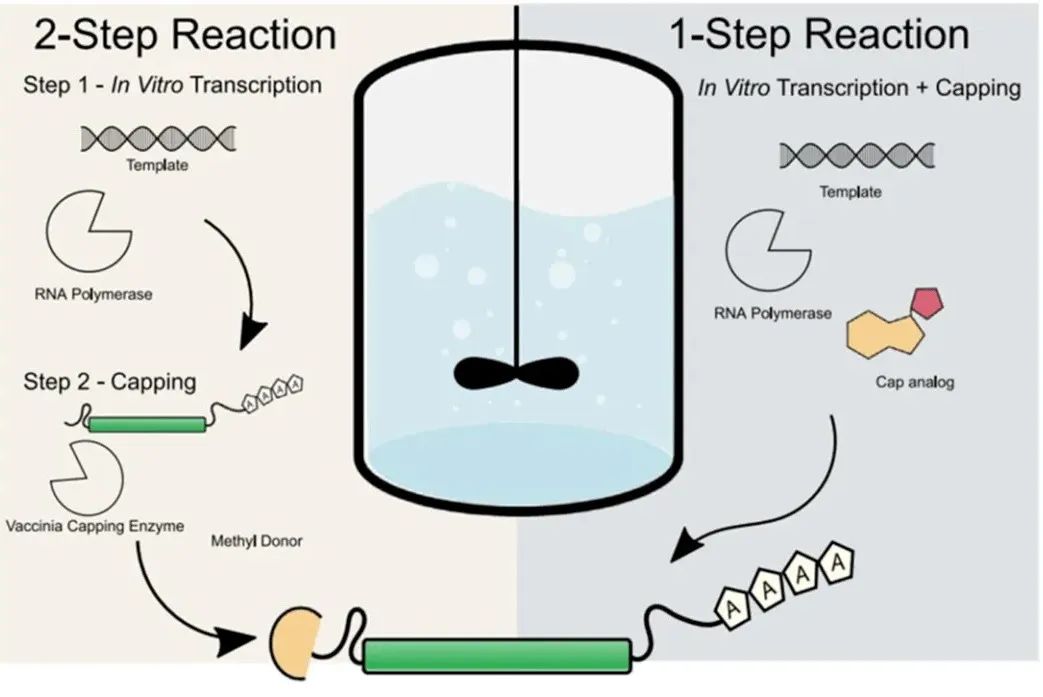
图4:mRNA疫苗生产流程[4]
一步法共转录加帽,就是在T7聚合酶参与的IVT反应体系中直接加入帽类似物,实现一步法获得含Cap1结构的mRNA,全程只需一次纯化。这种“一锅法”反应减少了制备步骤,进而有效缩短整体处理时间、简化纯化步骤,减少所需酶的数量。因此,化学法共转录加帽在工艺上相对简单,引入杂质少,能够迅速提升mRNA疫苗和药物的产能。目前,一步法共转录加帽正在逐步成为了mRNA制备工艺的主流技术路线。
帽类似物介绍
mRNA的CAP1帽子结构最早在1975年就已经被文献报道了其结构。经过多年的发展,帽类似物也从前一代的ARCA发展成为目前主流的三核苷酸帽类似物(CAP GAG)。在1984年的文献中,两种CAP1帽类似物CAP GAG以及CAP GAU的结构以及合成路线就已经被详细报道,并且在2009年这种三核苷酸CAP1帽类似物(CAP GAG)被报道可用于T7 RNA聚合酶的一步法共转录加帽体系制备mRNA。2020年,这种CAP1帽类似物(CAP GAG)也成功的应用在了新冠mRNA疫苗中。
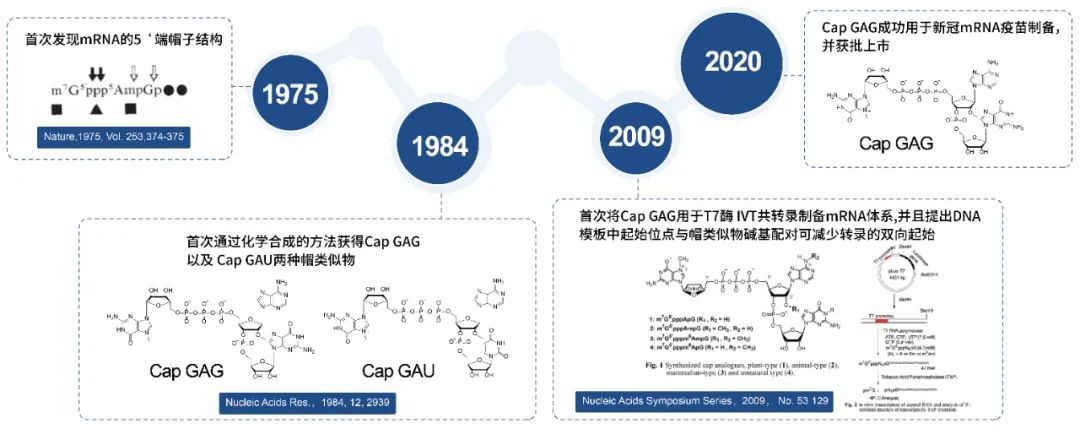
图5:帽类似物研究历程
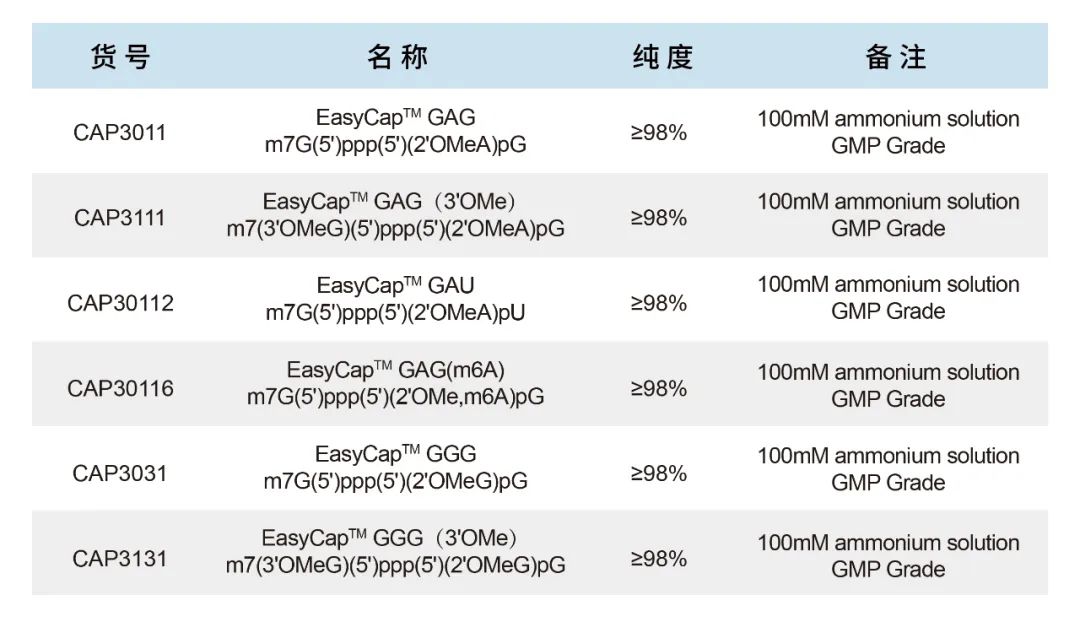
CAP GAG是单一组分的帽类似物,结构为m7G(5')ppp(5')(2'OMeA)pG,产品用于起始序列为5'-AG…的DNA模板,通过一步法共转录加帽产生天然的Cap1结构。Pfizer–BioNTech的COVID-19 mRNA疫苗是利用CAP GAG帽类似物进行共转录加帽。另外,CAP GAG(3'OMe)帽类似物结构为m7(3'OMeG)(5')ppp(5')(2'OMeA)pG,此帽类似物相对于CAP GAG来说,具有抗反向转录作用,在有一些DNA模板或者特殊序列中表现出更好的生物学效果。
以上两种帽类似物是目前mRNA制备中最常用的加帽试剂,目前国内已经有多个mRNA疫苗公司使用该产品开发的疫苗进入到临床实验。申基生物可大量提供高品质的CAP GAG和CAP GAG(3'OMe),货号分别为CAP3011和CAP3111。
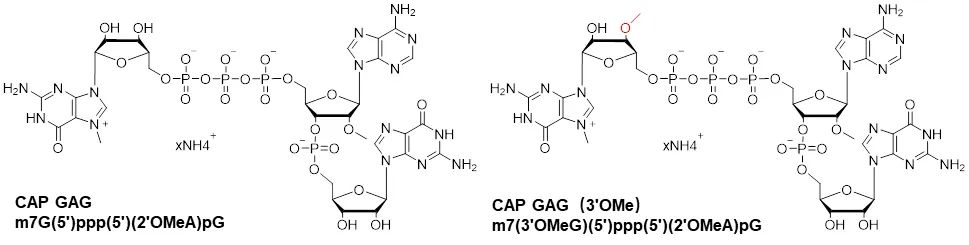
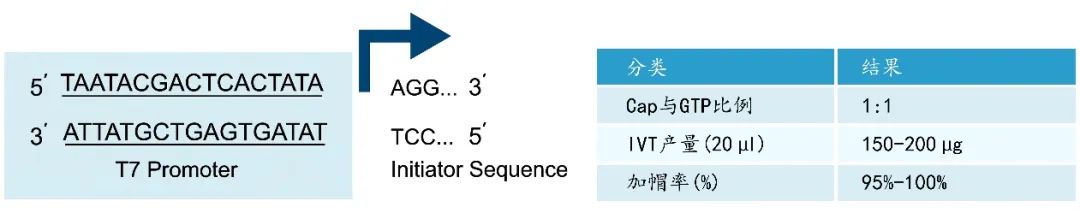
图6:CAP GAG和CAP GAG (3'OMe)结构式以及模板体系推荐示意图
CAP GAU结构为m7G(5')ppp(5')(2'OMeA)pU,专为自复制RNA(saRNA)设计的,该saRNA基于正义RNA病毒,如委内瑞拉马脑炎病毒(VEEV)、塞姆利基森林病毒(SFV)和辛德比斯病毒(SIN)的基因组,这些正义RNA病毒基因组起始是一个5'-AU…Cap1 mRNA。Ziphius公司开发的自复制mRNA疫苗—ZIP1642采用的就是CAP GAU进行共转录加帽,此款自扩增 RNA 疫苗可以在较低剂量下诱导等效或更有效的免疫反应。

图7:CAP GAU结构示意图[1]
mRNA中内部碱基的修饰会影响细胞中mRNA的命运,最普遍的碱基修饰是mRNA的5'端,即与7-甲基鸟苷帽相邻的第一个编码核苷酸处。m7G帽后的第一个核苷酸是2'-O-甲基腺苷(Am),它可以在N6位被未知的核质甲基转移酶进一步甲基化,形成m6Am。
研究发现,Cap1 (m6A)帽类似物可以增加mRNA的稳定性和翻译效率。2017年的Nature文献报道了5′Cap中的m6Am控制mRNA的稳定性。2018年的Science报道了5′Cap中的m6Am在mRNA的翻译过程中有重要的作用。其主要原因可能是Cap1 (m6A)帽类似物在体内具有更高的稳定性,不容易被DCP2等脱帽。

图8:CAP 1 (m6A)修饰的报告基因mRNA在老鼠体内具有更好的翻译效率[8]
除CAP GAG系列帽类似物以外,申基生物也可提供CAP GGG以及CAP GGG(3'OMe)结构的帽类似物。
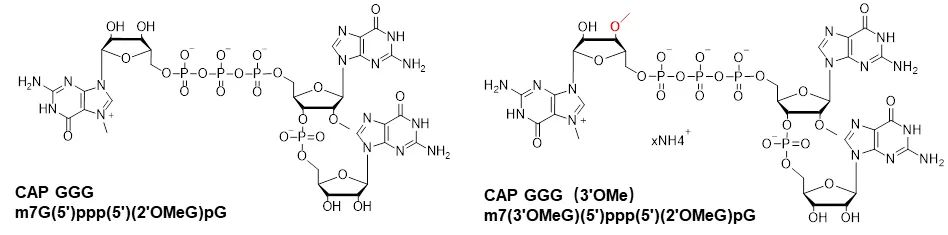
图9:CAP GGG以及CAP GGG(3'OMe)结构示意图
帽类似物结构本身包含很多可修饰位点,如糖环、磷脂键、碱基取代等等,结合帽类似物特异结合蛋白eIF4E的晶体结构,可以设计更多效果更好的新型帽类似物。当然,新型结构的帽类似物需要考虑:mRNA转录效率、加帽率、稳定性、翻译效率、免疫原性等关键因素。
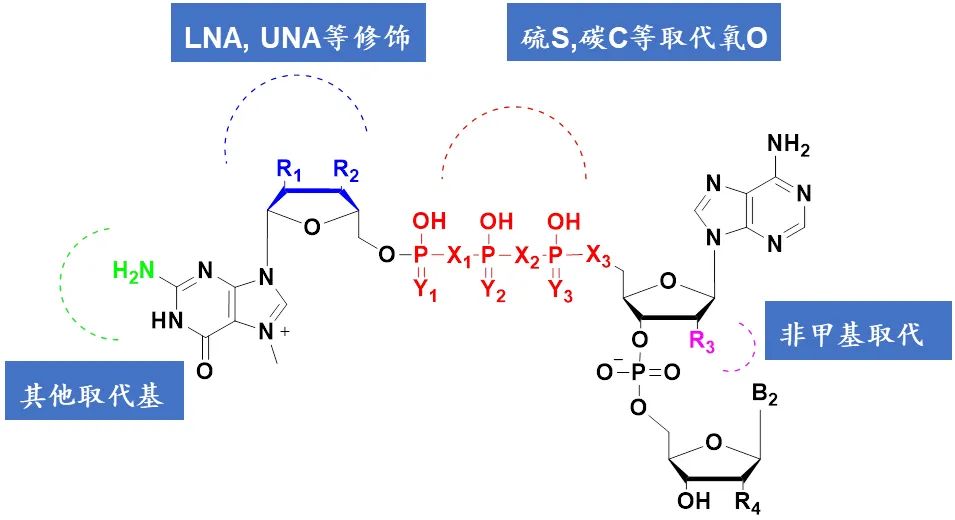
图10:帽类似物结构可修饰位点
一步法共转录加帽工艺研究
1、DNA模板
常用的一步法共转录体系的DNA模板序列有三种,分别为:
① 5’-TAATACGACTCACTATAGGG…-3’(图11),其中标黄区域为T7启动子区域;

图11:起始序列为GGG的DNA模板IVT示意图
② 5’-TAATACGACTCACTATAAGG…-3’(图12),其中标黄区域为T7启动子区域;

图12:起始序列为AGG的DNA模板IVT示意图
③ 5’-TAATACGACTCACTATAAT…-3’(自复制RNA的常用模板,图13),其中标黄区域为T7启动子区域;

图13:起始序列为AT的DNA模板IVT示意图
2、IVT反应体系
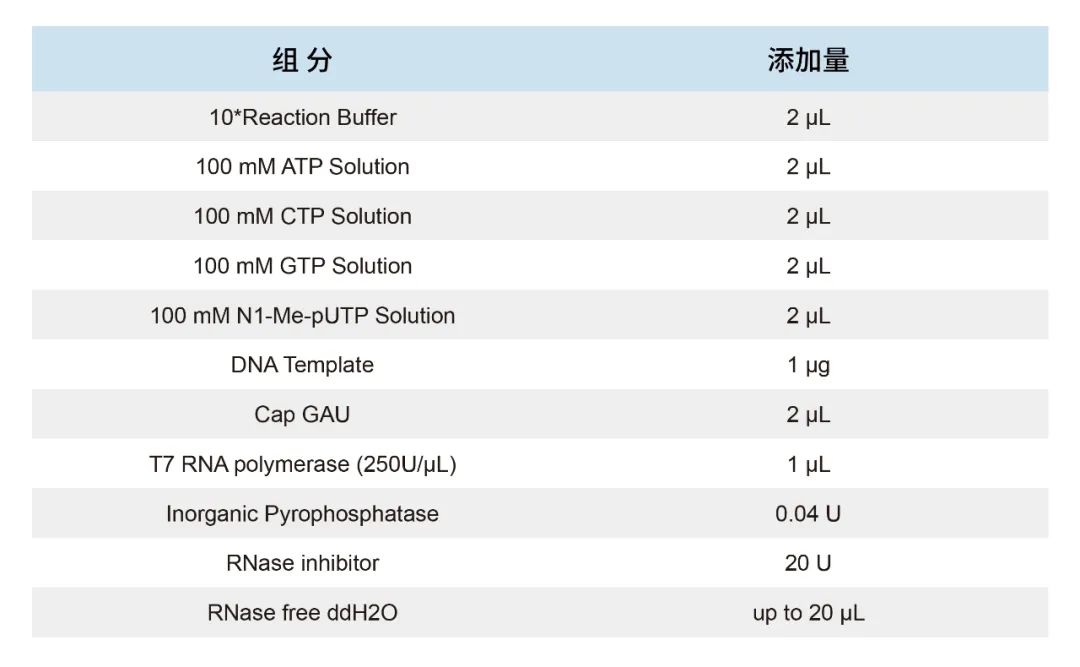
① 针对GGG模板,经我们大量实验验证,20 μL共转录体系推荐如下:

在上述体系下获得产量约在50-100 μg/20 μl体系,通常所获得的产物加帽率在95%以上。如增加GTP含量可显著增加产量,但会导致加帽率下降。
② 对于共转录体系,我们更推荐AGG模板,在此模板下,经大量实验验证,20 μL共转录体系如下:
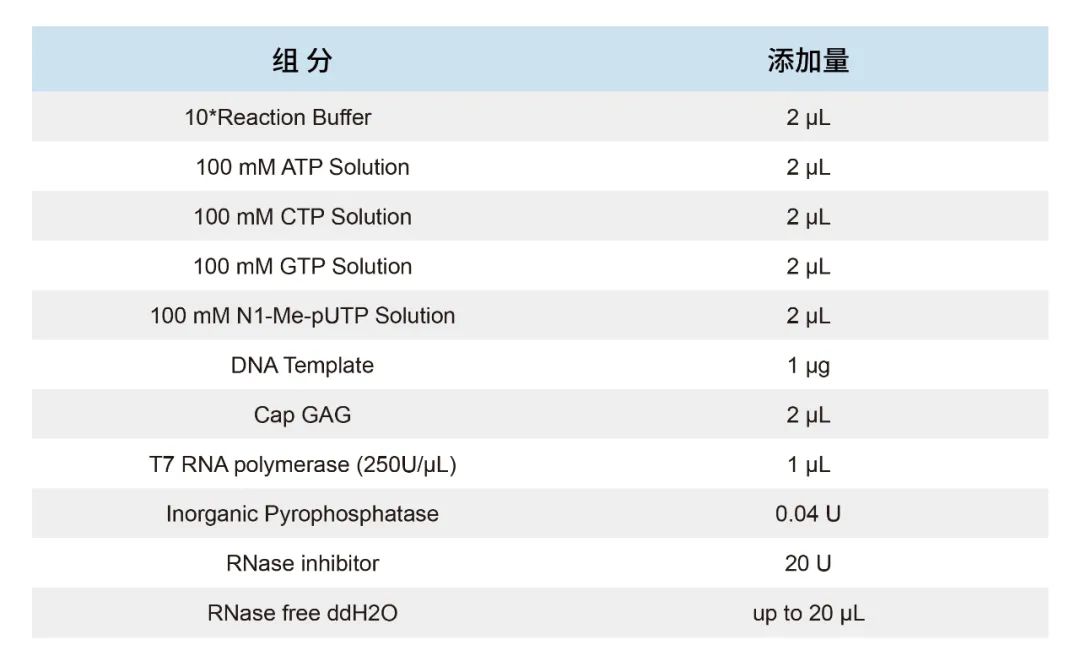
在上述体系下获得产量约在150-200 μg/20 μl体系,通常所获得的产物加帽率在95%以上。Cap用量对产量有所影响,推荐使用终浓度为8-10mM。因此,如果是5-GGG…起始的DNA模板,我们推荐可以做一个点突变,将模板突变为5’-GAG…,可以大大提高共转录加帽效果。
③ 对于自复制RNA共转录体系,我们推荐AT模板,在此模板下,经大量实验验证,20 μL共转录体系如下:
由于自复制RNA模板序列通常较长,IVT产量及产物完整性较常规模板低。
注:
1. 反应体系受酶活、体系buffer、模板长度、模板序列影响较大。推荐体系中酶量需视具体试剂盒而定,不同厂家试剂盒的酶活单位定义不同,以上体系仅作参考。
2. 在不同模板、不同酶体系下,需要适当调整NTPs及模板用量。
3、mRNA IVT效果评价
① IVT产量
经过大量实验验证,化学法共转录可以获得与普通IVT相当的Cap1 mRNA产量,20μL下产量对比如图14所示:

图14:化学法加帽IVT与普通IVT产量对比示意图
② 产物完整性
通过比较不同长度模板化学法共转录产物的完整性,我们发现mRNA产物的完整性均在85%以上,如下图所示:

图15:不同长度的模板化学法加帽IVT mRNA产物的完整性示意图
③ 产物加帽率
经过大量实验验证,一步法共转录产物的加帽率可稳定在98%以上,如下图所示:

图16:质谱检测化学法加帽mRNA产物的加帽率
④ 产物生物活性
将共转录得到的GFP mRNA转染进入细胞24h后,通过观察细胞内GFP的荧光(图17)发现未加帽的mRNA在细胞内几乎无表达,而化学法加帽的mRNA与酶法加帽的mRNA在细胞内的表达相当。

图17:转染不同mRNA细胞内GFP荧光表达情况
申基生物—— T7共转录试剂盒

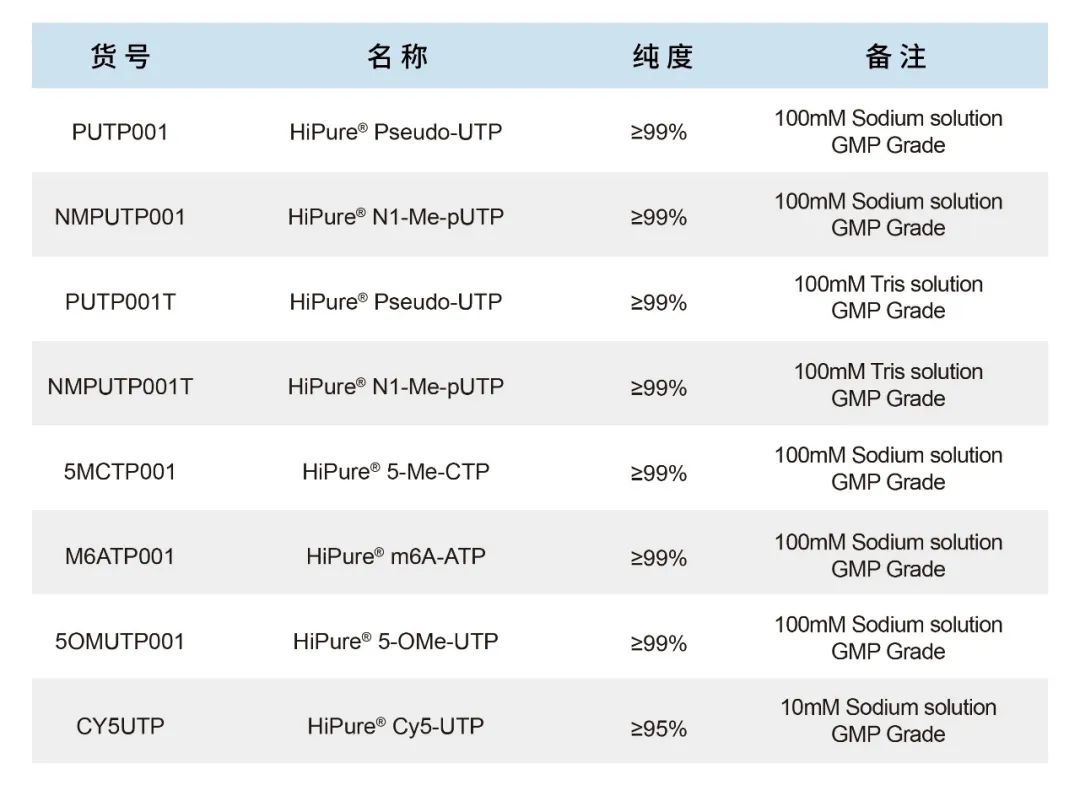
申基生物成功研发的T7 Co-transcription RNA Synthesis Kit(货号:10111)对体外共转录加帽反应体系进行了优化,1 μg的模板投入量可以产生150-200 μg的RNA。本试剂盒可一步完成mRNA原液的体外转录以及加帽。与酶法加帽对比,共转录加帽操作便捷、减少工艺复杂度,同时在保证加帽稳定(加帽效率95%以上)的情况下引入更少杂质。此外,本试剂盒利用N1-Me-pUTP替换天然的UTP,可极大降低产物的免疫原性!

申基生物作为拥有核心技术的mRNA疫苗上游原料供应商,现阶段已开发出来核苷酸、修饰性核苷酸、化学法加帽类似物等mRNA核心疫苗原料。同时,基于公司成熟的修饰性核苷酸、帽类似物类产品的研发以及规模化GMP产品的生产能力,还可以为客户定制合成具有自主知识产权的新型修饰核苷酸以及帽类似物。




产品订购咨询
400-885-0615
13851752674(微信同步)
15996265832(微信同步)
参考文献:
[1]Fang E , Liu X , Li M , et al. Advances in COVID-19 mRNA vaccine development[J]. Signal Transduction and Targeted Therapy, 2022, 7(4):31.
[2]Namit Chaudhary, Drew Weissman, Kathryn A. Whitehead. mRNA vaccines for infectious diseases: principles, delivery and clinical translation[J]. Nat Rev Drug Discov. 2021: 1–22.
[3]Montero H , R Garcí, Mora S I . eIF4E as a Control Target for Viruses[J]. Viruses, 2015, 7(2):739-750.
[4]Vaccine, doi:10.1016/j.vaccine.2021.03.038.
[5]Fabian, Muttach, Nils, et al. Synthetic mRNA capping.[J]. Beilstein journal of organic chemistry, 2017.
[6]Henderson J M, Ujita A, Hill E, et al. Cap 1 Messenger RNA Synthesis with Co-transcriptional [7]CleanCap Analog by In Vitro Transcription[J]. Current Protocols, 2021, 39(1): 1-17.
[8]https://www.trilinkbiotech.com/products-services/nucleoside-triphosphates-nucleotides/cap-analogs.html
[9]Sean McCafferty,A.K.M. Ashiqul Haque, Aster Vandierendonck,et al. A dual-antigen self-amplifying RNA SARS-CoV-2 vaccine induces potent humoral and cellular immune responses and protects against SARS-CoV-2 variants through T cell-mediated immunity[J]. Molecular Therapy, 2022.
[10]Mauer J , Luo X , Blanjoie A , et al. Reversible methylation of m(6)Am in the 5' cap controls mRNA stability[J]. Nature, 2016, 541(7637).
[11]Shinichiro, Akichika, Seiichi, et al. Cap-specific terminal N6-methylation of RNA by an RNA polymerase II-associated methyltransferase.[J]. Science, 2018.

SYNTHGENE

申基生物成立于2018年,是一家围绕核苷、核苷酸、诊断用抗原抗体等核心原料进行技术研发和产品开发的高科技企业,公司以提供高性价比的产品以及解决临床未满足需求为发展方向,先后进入了IVD、mRNA、CGT等产业的上游核心原料领域,已经建立优质的关键共性技术平台,为生命科学领域的发展提供整体解决方案。



 个人中心
个人中心
 我是园区
我是园区




