
点评 | 董晨 院士(上海市免疫治疗创新研究院)、林欣 教授(清华大学)
嵌合抗原受体T细胞
(
CAR-T
)
疗法是近年来兴起的一种新型过继免疫疗法。它将患者T细胞在体外进行基因改造,使T细胞表达识别肿瘤特定抗原的单链抗体和T细胞活化的信号结构域,经过体外扩增后回输至患者体内,从而实现肿瘤的靶向杀伤。近些年,CAR-T疗法得到了迅猛的发展,目前已有六款CAR-T产品被美国食品药品监督管理局
(FDA)
批准用于血液肿瘤的临床治疗,标志着CAR-T技术的巨大成功
【1】
。但是,现有CAR-T技术依然存在一些尚未解决的问题,包括生产成本高、制备时间长、工艺复杂、存在潜在的安全隐患、临床安全性和有效性有待提高等。当前,CAR-T细胞的制备主要是通过慢病毒感染的方式实现的,一方面病毒通过随机整合的方式将CAR序列插入到T细胞基因组中,增加了潜在的致瘤风险
【2】
。另一方面,T细胞可能会对病毒来源的DNA产生更多的免疫反应从而阻碍CAR的持续表达
【3】
,而且病毒的工业化制备需要高昂的成本。有研究报道可以利用转座子系统来制备CAR-T细胞,以解决使用病毒载体带来的弊端
【4】
。最近,有多项研究表明结合CRISPR/Cas9基因编辑技术和使用腺相关病毒
(AAV)
进行模板递送,可以成功制备定点整合型CAR-T细胞
【5】
。但是,这些方法仍然无法同时解决使用病毒和随机插入这两大问题。因此,亟需开发新一代的CAR-T技术来更好地解决这些问题。
2022年8月31日,来自华东师范大学生命科学学院张楫钦、刘明耀、杜冰、李大力团队、浙江大学医学院附属第一医院黄河团队等合作在Nature上在线发表了题为
Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL
的研究论文,
首次报道了一种创新性非病毒定点整合CAR-T技术的开发及其治疗复发难治性非霍奇金淋巴瘤的临床试验结果。该技术可以在不使用病毒载体的情况下,利用CRISPR/Cas9基因编辑技术将CAR序列定点插入到T细胞基因组的特定位点,一步实现CAR稳定整合和内源基因调控,有效解决了目前CAR-T技术存在的使用病毒和随机插入这两大问题。
为了在T细胞中提高大片段CAR序列在基因组特定位点的整合效率,研究人员首先对制备方法进行了摸索和优化。经过比较,发现当使用同源臂长度为800bp的线性双链DNA作为模板时,可以通过同源介导修复
(HDR)
机制获得数量最多的CAR整合细胞。在此基础上,研究人员选择在安全位点AAVS1制备靶向CD19的定点整合型CAR-T细胞
(AAVS1-19bbz)
,并与传统慢病毒感染的CAR-T细胞
(LV-19bbz)
进行比较,对该技术的可行性进行概念验证。检测结果显示CAR序列在AAVS1位点的平均整合效率为10%左右,最高可达19.8%。体外增殖、表面标志物表达、细胞因子分泌、体外肿瘤杀伤、小鼠体内肿瘤杀伤等检测表明AAVS1-19bbz与LV-19bbz具有相似的生物学特性,可以有效地杀伤肿瘤靶细胞,初步证明了非病毒定点整合CAR-T技术的可行性。
PD-L1/PD1信号通路是抑制T细胞功能的重要免疫检查点,目前针对PD-L1/PD1的抑制剂已经在多种类型的恶性肿瘤中取得了良好的疗效,也有不少研究报道了PD1敲除可以有效增强CAR-T细胞的功能
【6】
。因此,研究人员进一步地制备了靶向CD19非病毒PD1定点整合CAR-T细胞
(PD1-19bbz)
,并开展了系统的研究。在PD1位点,CAR序列的平均整合效率可达20%左右,最高为30.3%。与之前报道相一致,PD1下调并不会影响CAR-T细胞响应肿瘤靶细胞后表面标志物表达和细胞因子分泌。为了更好地研究PD1-19bbz的功能,研究人员采用慢病毒感染结合基因编辑的方法制备了PD1敲除的CAR-T细胞
(LV-19bbz_PD1-KO)
,并与LV-19bbz、AAVS1-19bbz和PD1-19bbz进行了平行比较。在小鼠体内肿瘤杀伤实验中,相比于其他组别,PD1-19bbz无论在PD-L1高表达还是低表达的肿瘤细胞中,都体现出更强大、更持久的杀伤效果,小鼠生存率得到显著提高。这提示PD1下调与非病毒定点整合CAR-T细胞制备方法可以联合提高CAR-T细胞的抗肿瘤功能。单细胞测序结果显示非病毒定点整合CAR-T细胞制备工艺本身能显著提高记忆性T细胞的比例,而PD1表达下调可以有效增强T细胞的抗肿瘤免疫功能,为这一现象提供了合理的机制解释。
在这些临床前研究的基础上,研究人员进一步开展了PD1-19bbz治疗复发难治性非霍奇金淋巴瘤的临床试验,对非病毒定点整合CAR-T细胞的临床安全性和有效性进行评估。在接受治疗的8例患者中,未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子风暴,证明了PD1-19bbz具有出色的临床安全性。检测结果显示PD1-19bbz回输后能在体内快速扩增并维持较长时间。接受治疗后,
有87.5%(7/8)的患者获得了疾病完全缓解(CR)的效果,所有患者均对治疗响应,客观缓解率(ORR)为100%,其中有5例患者响应时间超过1年。
值得一提的是,无论是针对PD-L1高表达肿瘤患者的治疗,还是在CAR-T细胞回输剂量和阳性率较低的条件下,PD1-19bbz均显示出良好的疗效,证明了其具有强大的肿瘤杀伤能力。研究人员对回输前后的CAR-T细胞进行了单细胞测序,结果显示回输前PD1-19bbz中存在较高比例的记忆性T细胞,回输后PD1低表达的CAR-T细胞具有更强的抗肿瘤功能,回输后存续的CAR-T细胞倾向于维持记忆性细胞的状态,为全面了解PD1-19bbz回输前后状态的变化并解释其临床表现提供了数据支持。
综上所述,
针对CAR-T细胞治疗领域存在的痛点,本研究开发了一种全新的非病毒定点整合CAR-T技术,并通过临床试验证明了其临床治疗的安全性和有效性。
利用CRISPR/Cas9基因编辑系统,该技术可以在不使用病毒载体的情况下,通过一步制备获得基因组精确整合的CAR-T细胞,同时实现CAR稳定表达和内源基因调控,有效解决了目前CAR-T技术存在的使用病毒和随机插入这两大问题。相比于其他现有CAR-T技术,该技术具有生产成本低、制备时间短、工艺简单、产品均一性高等优点,能有效增强CAR-T细胞临床治疗的安全性和有效性。
本研究证明了基因编辑技术在免疫细胞治疗应用中的可行性和安全性,为解决CAR-T治疗领域现存的问题提供了新的方法和思路,对推动CAR-T技术的进一步发展有着重要意义。
论文审稿人、UCLA的Justin Eyquem教授评论该工作:
“这项研究报道了首个PD1下调定点整合型CAR-T细胞的临床试验。研究人员在临床治疗中观察到了高比例的肿瘤完全缓解率,且未发现严重的毒副作用,这一令人惊喜的结果显示出这种CAR-T疗法具有出色的临床安全性和有效性。研究人员同时也证明了非病毒定点整合T细胞治疗在临床应用的可行性。这一技术创新为未来更多基因靶向修饰CAR-T疗法的发展奠定了坚实的基础,对领域发展具有重要的推动作用。”
Nature杂志资深编辑Victoria Aranda评价该工作:
“这项研究工作开展了全面系统的临床前研究,成功开发了非病毒定点整合CAR-T疗法。研究人员展现了令人鼓舞的早期临床试验结果,显示出这种疗法在非霍奇金B细胞淋巴瘤中具有出色的安全性和有效性。”
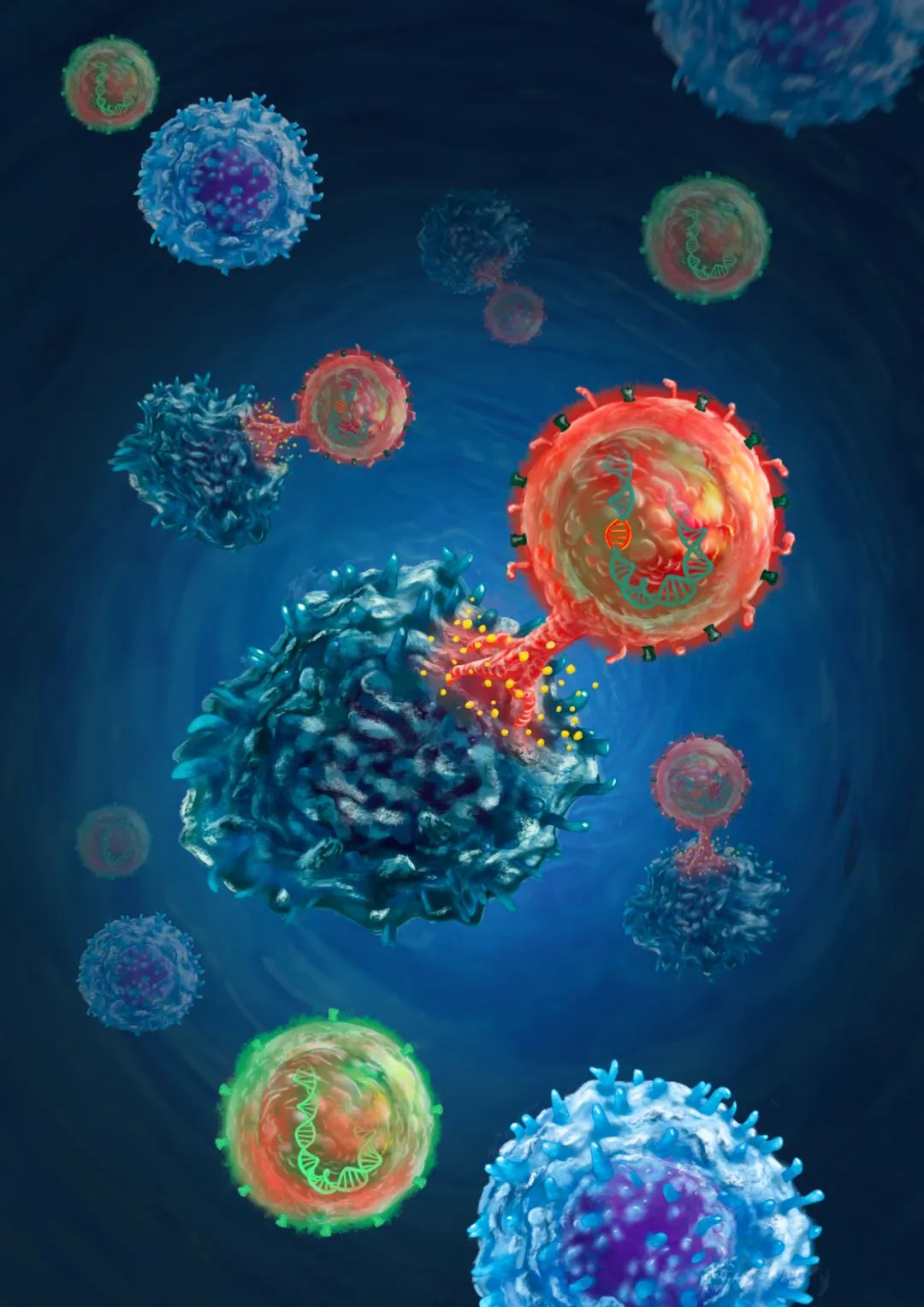
图:PD1定点整合CAR-T细胞(红色)正杀灭肿瘤细胞(深蓝色);未编辑的T淋巴细胞(绿色)无法有效杀伤肿瘤细胞(亮蓝色)
华东师范大学生命科学学院张楫钦副研究员为论文第一作者、共同通讯作者,浙江大学医学院附属第一医院黄河教授为论文通讯作者,华东师范大学生命科学学院刘明耀教授、杜冰教授、李大力研究员为论文共同通讯作者。浙江大学医学院附属第一医院胡永仙教授、华东师范大学生命科学学院杨佳璇硕士为本文共同第一作者。
https://doi.org/10.1038/s41586-022-05140-y
 董晨
(
中国科学院院士、上海市免疫治疗创新研究院院长
)
董晨
(
中国科学院院士、上海市免疫治疗创新研究院院长
)
自从2013年美国《科学》杂志将肿瘤免疫疗法评为年度十大科学突破以来,这个领域有了飞速的发展。大量研究表明PD-L1/PD1信号通路是抑制T细胞功能的重要免疫检查点,阻断此信号通路可以有效增强T细胞的抗肿瘤功能。目前,国内外已有多款针对PD-L1/PD1通路的抑制剂被批准用于多种恶性肿瘤的临床治疗并取得了良好的疗效,但是与此同时也有为数不少的患者会产生免疫相关的副反应。因此,将PD1调控与CAR-T细胞治疗相结合是一个极具潜力的临床研究方向。
为了探索这种可能性,张楫钦等研究人员基于自主开发的新一代非病毒定点整合CAR-T技术,成功制备了靶向CD19的PD1下调定点整合型CAR-T细胞。该技术可以在不使用病毒载体的情况下,通过一步电转完成CAR序列在PD1位点的精确插入,同时实现CAR稳定表达和PD1基因敲除,起到一箭双雕的作用。在临床前研究充分证实CAR-T细胞有效性的基础上,研究人员进一步开展了非霍奇金淋巴瘤治疗的临床试验,并证明了这一全新CAR-T疗法具有出色的临床安全性和有效性。
这项跨越基础研究到临床转化的研究工作进一步证实了抑制PD1信号在CAR-T临床治疗中的有效性,揭示了不同制备方法对CAR-T细胞带来的不同影响,也为今后多样化CAR-T疗法的开发提供了新的思路和方向。这一令人鼓舞的早期临床试验结果让我们期待它在大样本、多中心临床试验中的表现,并获取CAR-T细胞是否能长期维持等研究结果。我也相信将来会有更多定点(如T细胞受体位点)整合型CAR-T产品用于包括实体肿瘤在内更多适应症的临床治疗,也憧憬未来基因编辑与细胞治疗能碰擦出更大的火花。
 林欣
(
清华大学医学院教授
)
林欣
(
清华大学医学院教授
)
CAR-T疗法是近年来兴起的一种新型过继免疫疗法,自从2017年首次获批临床治疗以来,该领域得到了非常迅猛的发展。目前,已经有六款和两款CAR-T产品分别被美国FDA和中国NMPA批准用于血液肿瘤的临床治疗,并取得了振奋人心的临床效果,显示出CAR-T疗法具有巨大的发展潜力。但是,目前获批的CAR-T产品都是通过病毒感染的方式来进行CAR-T细胞的制备,因此存在生产成本高、制备时间长、工艺复杂、有随机插入引起的潜在致瘤风险等问题。
随着近年来CRISPR/Cas9基因编辑等新兴技术的发展,为CAR-T技术的进一步优化和提升提供了更多可能。早年前,科学家们就已经提出将基因编辑技术与CAR-T技术相结合,通过基因敲除方式来制备通用型CAR-T细胞。最近,又有多项研究报道利用基因编辑技术可以实现定点整合型CAR-T细胞的制备。但是,仍然依赖病毒载体的使用、阳性率较低等问题依然困扰着CAR-T细胞精准化改造的进一步发展。此外,新一代CAR-T技术能否满足大规模工业化制备的要求,临床治疗的安全性和有效性如何也有待更多的研究。
针对这些问题,张楫钦等研究人员开展了全面系统的研究工作,通过载体类型、模板设计、细胞状态等方面的条件摸索和参数优化,确定了最佳的制备方法,成功开发了非病毒定点整合CAR-T技术。在完成概念验证后,研究人员制备了PD1定点整合增强型CAR-T细胞,并通过早期临床试验证明了其出色的临床安全性和有效性。这一全新一代的CAR-T制备技术可以有效解决目前CAR-T细胞制备存在的使用病毒和随机插入这两大问题,能大幅降低生产成本、缩短制备时间、简化生产工艺,也避免了随机插入带来的致瘤风险,提高了CAR-T细胞的均一性,保证了CAR-T产品的安全性和有效性。这一创新性的CAR-T技术极大丰富了未来CAR-T细胞的产品类型,比如它可用于多基因调控增强型CAR-T细胞的构建,用于动态调控安全型CAR-T产品的制备,也可用来快速生产通用型CAR-T细胞。这项研究进一步推动了基因编辑与免疫细胞治疗的结合,对细胞治疗领域的发展具有重要意义。相信随着今后更多长片段DNA定点整合技术的开发,细胞精准化改造的空间有望进一步提升,细胞治疗的发展也会迈向新的高度。
张楫钦博士即将在华东师范大学组建独立实验室,课题组将以解决未被满足的临床需求为导向,开展基因编辑与免疫细胞治疗方面的研究工作。课题组拟从利用CRISPR/Cas9基因编辑工具开发实体瘤治疗的增强型CAR-T技术、寻找改进CAR-T疗法的重要蛋白并研究其作用机制和功能、利用新一代基因编辑工具开发创新型CAR-T技术、结合前沿技术开发新一代免疫细胞疗法等方面着手,解决领域内重大的科学问题,并开发新一代的细胞治疗药物。张楫钦课题组近期招聘博士后、副研究员、助理研究员等多个岗位。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
制版人:十一
1. Larson, R. C. & Maus, M. V. Recent advances and discoveries in the mechanisms and functions of CAR-T cells. Nat Rev Cancer 21, 145-161 (2021).
2. Russo-Carbolante, E. M. D. et al. Integration pattern of HIV-1 based lentiviral vector carrying recombinant coagulation factor VIII in Sk-Hep and 293T cells. Biotechnology Letters 33, 23-31 (2011).
3. Atianand, M. K. & Fitzgerald, K. A. Molecular basis of DNA recognition in the immune system. J Immunol 190, 1911-1918 (2013).
4. Monjezi, R. et al. Enhanced CAR-T-cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors. Leukemia 31, 186-194 (2017).
5. Eyquem, J. et al. Targeting a CAR-To the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 543, 113-+ (2017).
6. Cherkassky, L. et al. Human CAR-T cells with cell-intrinsic PD-1 checkpoint blockade resist tumor-mediated inhibition. Journal of Clinical Investigation 126, 3130-3144 (2016).

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。



 董晨
(
中国科学院院士、上海市免疫治疗创新研究院院长
)
董晨
(
中国科学院院士、上海市免疫治疗创新研究院院长
)
 林欣
(
清华大学医学院教授
)
林欣
(
清华大学医学院教授
)





 个人中心
个人中心
 我是园区
我是园区






