
责编 | 兮
生物体的衰老常常伴随着多组织和器官的生理功能丧失。其中,由于衰老导致的骨骼肌(skeletal muscle)质量和力量的损失在临床上称为“肌肉减少症” (sarcopenia)。随着年龄的增长,肌肉减少症的发病率从 65 至 70 岁人群中的 14% 增加到 80 岁以上人群中的 53% 【1】,并于 2000 年被世界卫生组织认定为是造成多种高龄疾病的危险因素之一,且对老年人的独立有着重要的威胁。
在成年生物体中,肌肉的再生(regeneration)主要依赖于肌肉干细胞(muscle stem cells,又称为satellite cells) 的扩增(proliferation)和分化(differentiation)。这种干细胞在常态下(under homeostasis)处于静止状态(quiescent state), 但可在损伤或压力的触发下迅速扩增并分化而形成新的肌肉纤维,以修补受到破坏的肌肉。随着年龄的增长,肌肉干细胞的数量和功能都受到影响,导致肌肉再生变得不再有效。尽管近十年来关于肌肉干细胞衰老的研究激增,到目前为止,科学家们对肌肉干细胞的了解还非常有限。
西班牙通国家心血管研究中心 (CNIC) 高级研究员、巴塞罗那庞培法布拉大学 (UPF) 教授Pura Muñoz-Cánoves博士的课题组致力于肌肉干细胞功能几衰老的研究。2014年,他们发现了肌肉干细胞的功能在28个月以上的超高龄小鼠(geriatric mice)中极具下降,而干细胞的老化(senescence)是导致这一现象的主要原因【2】。2016年,他们进一步揭示了细胞自噬(autophagy)是肌肉干细胞维持自身功能的主要机制之一 【3】。这两个重要的发现均于Nature发表。2020年,该课题组在Nature Cell Biology上发表了转录因子FoxO对肌肉干细胞功能的影响机制,以及对肌肉干细胞衰老的保护作用(详见BioArt报道:NCB | FoxO家族转录因子与肌肉干细胞的维持)【4】。
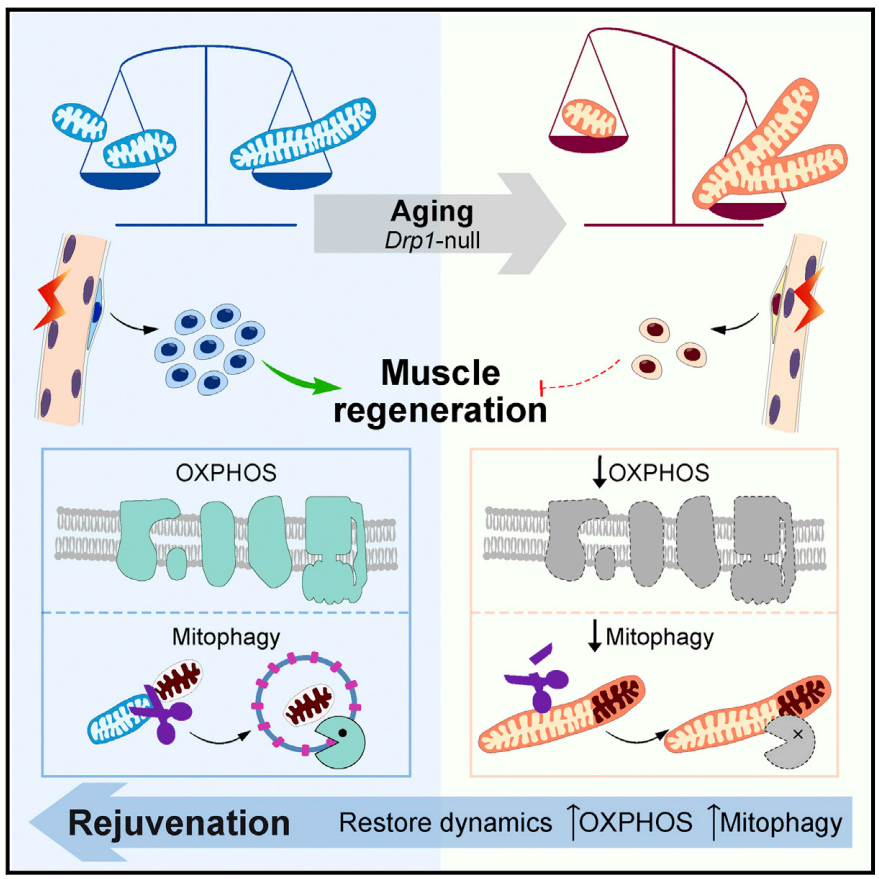
2022年8月22日,Pura Muñoz-Cánoves课题组在Cell Stem Cell上发表了题为: Mitochondrial dynamics maintain muscle stem cell regenerative competence throughout adult life by regulating metabolism and mitophagy的研究论文,首次呈现了肌肉干细胞的中线粒体动力学(Mitochondrial dynamics),并揭示了线粒体动力学,尤其是线粒体分裂(mitochondrial fission)对肌肉干细胞功能的影响及其机制。

参考文献
1. Santilli, V., Bernetti, A., Mangone, M. & Paoloni, M. (2014). Clinical definition of sarcopenia. Clin Cases Miner Bone Metab 11, 177–80.
2. Sousa-Victor, P., Gutarra, S., García-Prat, L., Rodriguez-Ubreva, J., Ortet, L., Ruiz-Bonilla, V., Jardí, M., Ballestar, E., González, S., Serrano, A.L., et al. (2014). Geriatric muscle stem cells switch reversible quiescence into senescence. Nature 506, 316–321.
3. García-Prat, L., Martínez-Vicente, M., Perdiguero, E., Ortet, L., Rodríguez-Ubreva, J., Rebollo, E., Ruiz-Bonilla, V., Gutarra, S., Ballestar, E., Serrano, A.L., et al. (2016). Autophagy maintains stemness by preventing senescence. Nature 529, 37–42.
4. García-Prat, L., Perdiguero, E., Alonso-Martín, S., Dell’Orso, S., Ravichandran, S., Brooks, S.R., Juan, A.H., Campanario, S., Jiang, K., Hong, X., et al. (2020a). FoxO maintains a genuine muscle stem-cell quiescent state until geriatric age. Nat. Cell Biol. 22, 1307–1318.
5. Pala, F., Di Girolamo, D., Mella, S., Yennek, S., Chatre, L., Ricchetti, M., and Tajbakhsh, S. (2018). Distinct metabolic states govern skeletal muscle stem cell fates during prenatal and postnatal myogenesis. J. Cell Sci. 131.
6. Hong, X., Campanario, S., Ramírez-Pardo, I., Grima-Terrén, M., Isern, J., and Muñoz-Cánoves, P. (2022). Stem cell aging in the skeletal muscle: The importance of communication. Ageing Res. Rev. 73, 101528.


转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




