▎药明康德内容团队编辑
今日,Santhera Pharmaceuticals和ReveraGen BioPharma公司联合宣布,杜氏肌营养不良症(DMD)在研药品vamorolone于VISION-DMD临床2b试验积极结果,发表于顶尖期刊JAMA Neurology中。两家公司预定将于2022年第3与第4季度,分别向欧洲药品管理局(EMA)与美国FDA完成药品的监管申请。

DMD是一项罕见的X-染色体连锁遗传疾病,是由于在X染色体上编码抗肌萎缩蛋白(dystrophin)的基因出现突变而导致,因此几乎只影响男性患者,是最常见的儿童神经肌肉疾病之一。DMD特征为在出生时或出生后短时间内出现炎症反应,进而导致肌肉纤维化,以及临床上肌肉的萎缩与退化。疾病进展的里程碑包含患者丧失步行与进食能力,以及需要呼吸辅助与心肌疾病的产生。由于呼吸与/或心脏衰竭之故,DMD患者的预期寿命通常不超过40岁。皮质类固醇(corticosteroids)是DMD儿童与成人患者的标准治疗药物,然而这些激素虽然可以延缓疾病进展,但却具许多副作用。
Vamorolone是一款在研药物,虽然可与之结合的受体与皮质类固醇相同,但能够具选择性地激活类固醇的某些信号通路
,因此被认为属于“游离型(dissociative)”抗炎症药物。亦即在引发抗炎症效果的同时,具潜力避免(“游离”)传统类固醇所带来的安全性顾虑与副作用,进而可能取代现有疗法。Vamorolone获得美国与欧洲用以治疗DMD的孤儿药资格,并获得美国FDA快速通道资格与罕见儿科疾病认定。此药物具潜力成为“first-in-class”游离型类固醇疗法。
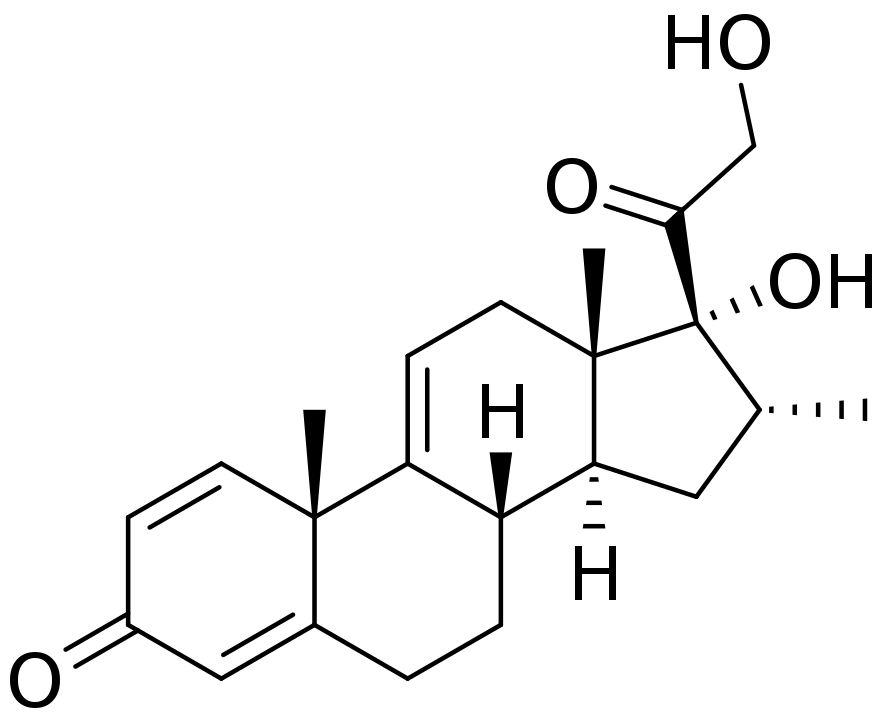
▲Vamorolone分子结构式(图片来源:Fvasconcellos (talk · contribs), Public domain, via Wikimedia Commons)
此次所发表的数据显示,vamorolone于24周时达成试验主要终点。与安慰剂组相较,药物组患者在从仰卧到站立所需时间这项指标上,呈现统计上显著并具临床意义的改善。此项目为DMD儿童患者疾病恶化的第一项功能性指标。许多次要终点的结果也与主要终点结果一致。分析显示,使用6 mg/kg/day的vamorolone可与0.75 mg/kg/day 强的松(prednisone),在主要与次要疗效终点上达成相当的效果。此外,在为期24周的试验中,没有发现vamorolone在骨骼健康生物标志与线性生长上有负面的影响。与安慰剂组相较,最常见的不良反应为库兴样特征(cushingoid features,如圆脸与驼肩等)、呕吐与维生素D缺乏。大多数的不良反应属于轻或中度。
“来自VISION-DMD试验的数据持续验证了我们开发保有传统皮质类固醇的疗效,同时减少部分毒性的类固醇样疗法的雄心。这些毒性常常是造成DMD儿童过早停止治疗的原因。”ReveraGen公司首席执行官Eric Hoffman博士说道。
药明康德为全球生物医药行业提供一体化、端到端的新药研发和生产服务,服务范围涵盖化学药研发和生产、生物学研究、临床前测试和临床试验研发、细胞及基因疗法研发、测试和生产等领域。如您有相关业务需求,欢迎点击下方图片填写具体信息。
▲如您有任何业务需求,请长按扫描上方二维码,或点击文末“阅读原文/Read more”,即可访问业务对接平台,填写业务需求信息
参考资料:
[1] JAMA Neurology Publishes Positive Pivotal Clinical Trial with Vamorolone in
Duchenne Muscular Dystrophy. Retrieved September 1, 2022 from https://www.santhera.com/assets/files/press-releases/2022-09-01_JAMANeurol_e_final.pdf
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。









 个人中心
个人中心
 我是园区
我是园区




