
1979年科学家首次发现抑癌因子p53,目前在PubMed 数据库上,我们可以搜索到超过 100000 篇与p53相关的研究,这些研究大多集中于探索p53在癌症中的作用。细胞外或细胞内应激信号均可诱导p53的表达,比如DNA 损伤、癌基因激活、核糖体或端粒相关应激和营养缺乏。p53主要发挥转录因子的作用,通过募集转录共激活因子来协调众多下游信号通路,导致DNA损伤修复、细胞周期停滞、细胞凋亡、衰老或铁死亡【1, 2】。
p53的翻译后修饰,尤其是乙酰化修饰,对于其转录功能至关重要。顾伟教授作为p53乙酰化修饰的发现者,多年来从事p53乙酰化修饰和癌症的相关研究。1997年,顾伟教授首次发现p53的C端结构域 (C terminal Domain, CTD) 可以被乙酰化修饰从而促进其蛋白稳定【3】。不仅如此,p53 乙酰化也可以通过阻止 MDM2 募集到 p53结合的靶基因启动子区来促进靶基因的表达【4】。进一步研究发现,p53的DNA结合结构域 (DNA binding Domain, DBD) 的乙酰化修饰对于其转录活性至关重要: p53 K120位点的模拟低乙酰化修饰的突变体K120R失去对PUMA基因的激活能力,从而无法诱导细胞凋亡【5】;p53的K164位点(对应于小鼠p53的K161和K162位点)的模拟低乙酰化修饰的突变体K164R失去对p21的激活能力,从而无法诱导细胞周期阻滞和衰老。利用p53-3KR(K120R,K161R和K162R) 突变小鼠模型,课题组发现p53在失去诱导细胞周期停滞,凋亡和衰老后,依然具有抑癌功能,进一步研究发现p53可以通过调节细胞代谢来抑制肿瘤【6】。并且研究人员还发现,尽管p53无法激活p21和PUMA等众多基因的转录,但其在靶基因启动区的富集是没有改变的。所以,探索p53-3KR是如何失去其转录活性的机制成为了阐释p53转录激活调节中十分关键的问题。
2021年10月27日,美国纽约哥伦比亚大学癌症遗传研究所顾伟课题组在Science Advances杂志上发表题为An unexpected role for Dicer as a reader of the unacetylated DNA-binding domain of p53 in transcriptional regulation的文章,揭示了一个全新的p53负调控蛋白——Dicer,其可以作为非乙酰化p53的识别蛋白,对于p53转录激活起到调控作用。

论文延续之前的工作基础,为了探索p53的 DNA结合结构域上潜在的转录激活或抑制的蛋白,课题组首先构建SFB标签的p53-DBD+TD结构域的稳定表达的H1299细胞系。进一步利用蛋白质免疫共沉淀实验和联合质谱分析技术,研究人员鉴定出Dicer是主要且特异地与p53-DBD结合的蛋白。Dicer是一种核糖核酸内切酶,它可以将RNA切割降解为21-23bp的双链RNAs,对于microRNA 和siRNA的合成至关重要。目前,与Dicer相关的RNA领域的研究已经非常全面,但是Dicer在转录调控中的功能目前知之甚少。由于Dicer的蛋白分子量为220kDa,因此研究人员为了证实他们的结合是特异的,首先通过一系列的蛋白质结构域分段免疫共沉淀实验发现Dicer 氨基酸1379到1551的肽段是主要和p53结合的区域。其次,通过一系列的内源免疫共沉淀实验证实在生理状态下p53也可以与Dicer结合,且结合存在于细胞核中。
进一步的细胞学实验证实,Dicer确实可以调控p53的转录水平:1)Dicer敲除的HCT116细胞中尽管p53的蛋白水平没有变化,但是其下游基因p21和PUMA的mRNA和蛋白质水平均明显上升;2)共表达实验则证实Dicer能抑制p53的转录活性,且不依赖于Dicer的酶活性。这里值得一提的是,Dicer对于p53的下游基因调节是具有选择性的,MDM2和TIGAR则不会受到影响。此前研究发现,p53-3KR具有和野生型p53相同的激活MDM2和TIGAR转录的活性,因此Dicer选择性的转录调节提示研究人员,该现象可能和p53-3KR具有一定联系。通过结构域分段免疫共沉淀实验发现,Dicer主要和p53氨基酸100到180肽段结合。通过进一步蛋白质结合的实验,研究人员惊奇地发现Dicer与非乙酰化的p53-DBD结合能力显著地高于野生型p53,而且p53-DBD乙酰化则显著抑制这种相互作用。这提示p53-3KR之所以在不影响和下游基因启动区的结合的情况下能够抑制p53转录活性,很有可能是由于Dicer与p53-3KR的结合增强所导致的。
为了研究Dicer对p53-3KR的调控作用,研究人员建立了四环素诱导的Tet-On 鼠源p53野生型和p53-3KR突变型的H1299细胞系,进一步在p53-3KR细胞系中敲低Dicer。p53-3KR 能够激活 MDM2 的表达,但不能激活 p21 或PUMA的表达,且敲低Dicer后的细胞能够再次激活 p21 或PUMA的表达。然而敲低另外两个关键的microRNA合成蛋白Drosha或DGCR8则不能够再次激活 p21 或PUMA的表达,充分说明在这过程中p53和Dicer相互作用是至关重要的。在p53-3KR小鼠胚胎成纤维细胞 (Mouse Embryonic Fibroblasts, MEFs) 中敲低Dicer也能够观察到p21 或PUMA的表达激活,证实这种调节在生理状态下也是发挥作用的。
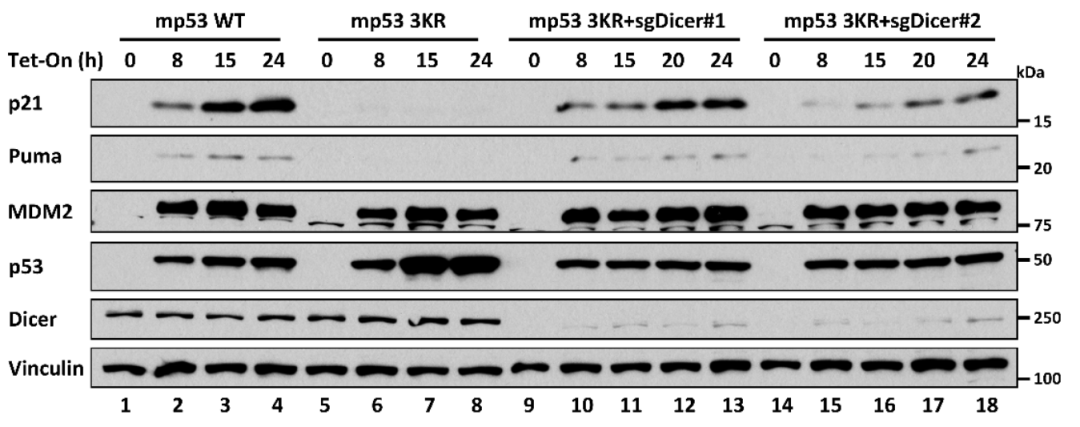
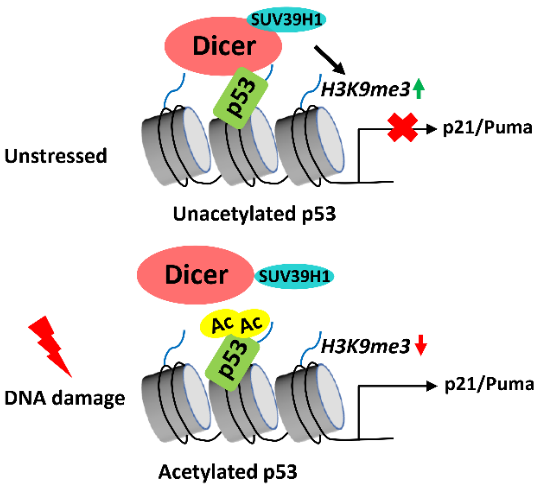
机制研究上,Dicer作为p53的转录共抑制因子,通过与p53的相互作用被招募到p53下游靶基因的启动子区,发挥抑制p53转录活性的作用。Dicer在不影响p53的蛋白稳定性以及p53在靶基因启动子区的结合能力的情况下,通过结合并募集甲基转移酶SUV39H1影响p53靶基因启动子区组蛋白H3K9的三甲基化水平并特异地调控p21和PUMA,而不影响MDM2和TIGAR的转录。
本研究证实了p53转录激活需要多种方式,包括SET和Dicer多种负调节因子都可以在非应激和不影响p53蛋白质水平的情况下来激活p53,且这种调节是受p53乙酰化水平所控制的【7】。本研究进一步证实应激条件下 p53激活进而促进靶基因表达是通过p53 表达上调和p53 乙酰化来共同发挥作用的。
美国纽约哥伦比亚大学顾伟教授为通讯作者,顾伟课题组博士后杨鑫为本文第一作者,美国纽约哥伦比亚大学张志国教授,西奈山伊坎医学院金坚教授等参与了该论文的研究工作。
参考文献
1. J. P. Kruse, W. Gu, Modes of p53 regulation. Cell 137, 609-622 (2009).
2. L. Jiang, N. Kon, T. Li, S.J. Wang, T. Su, H. Hibshoosh, R. Baer, W. Gu. Ferroptosis as a p53-mediated activity during tumour suppression. Nature 520, 57-62 (2015).
3. W. Gu, R. G. Roeder, Activation of p53 sequence-specific DNA binding by acetylation of the p53 C-terminal domain. Cell 90, 595-606 (1997).
4. Y. Tang, W. Zhao, Y. Chen, Y. Zhao, W. Gu, Acetylation is indispensable for p53 activation. Cell 133, 612-626 (2008).
5. Y. Tang, J. Luo, W. Zhang, W. Gu, Tip60-dependent acetylation of p53 modulates the decision between cell-cycle arrest and apoptosis. Mol. Cell 24, 827-839 (2006).
6. T. Li, N. Kon, L. Jiang, M. Tan, T. Ludwig, Y. Zhao, R. Baer, W. Gu, Tumor suppression in the absence of p53-mediated cell-cycle arrest, apoptosis, and senescence. Cell 149, 1269-1283 (2012).
7. D. Wang, N. Kon, G. Lasso, L. Jiang, W. Leng, W. G. Zhu, J. Qin, B. Honig, W. Gu, Acetylation-regulated interaction between p53 and SET reveals a widespread regulatory mode. Nature 538, 118-122 (2016).
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




