责编 | 酶美
当环境因素影响到生物体的体征【1】、代谢【2】、行为【3】和寿命【4】等生理和行为特征后,机体会以非遗传信息的形式将这种影响因素传递给后代,即为表观遗传。表观遗传可以通过与DNA序列变化无关的信息,如通过DNA的甲基化、组蛋白的修饰、非编码RNA以及小RNA等传递信息给后代,这种现象称为跨代表观遗传(Transgenerational Epigenetic Inheritance,TEI)【5】。
温度是重要的环境因素,机体的环境经历不可避免地包括温度的影响。已有研究表明,轻度的热应激(包括由轻度的高温刺激或短期致死性的高温刺激所引起的热应激)可延长机体的寿命和增加其抗逆性。这种对压力耐受力的适应性诱导被称为“低毒性兴奋效应”,该现象已经在果蝇【6】、人成纤维细胞【7】和线虫【8】等多种物种中被观察到。轻度的热休克会引起低毒性兴奋效应,是因为它们会导致热休克蛋白(HSP)的激活,进而达到延长寿命的效果。
在线虫中,已有研究发现并阐明轻度热压力导致的兴奋性效应机制,即当线虫被暴露于高温环境下,会导致激烈的热应激,而激活包括HSF-1,DAF-16/FOXO,HLH-30/TFEB和核受体DAF-12等一系列转录因子,进而上调应激反应基因(hsp-70,hsp-16.2和hsp-12.6)和自噬基因(lgg-1,bec-1和unc-51),最终达到延长寿命和增加抗逆性的效应【8,9】。
既然热激能够增加模式生物的抗逆性、有助于蛋白稳态的维持,并延长寿命。而高温记忆又可通过跨代表观遗传传递给后代。那么,热应激引起的生存优势是否也有跨代遗传(TEI)现象呢?如果有,其机制是什么呢?。
2021年1月1日,来自暨南大学的周庆华课题组在Science Advances上发表了题为N6-methyldeoxyadenine and histone methylation mediate transgenerational survival advantages induced by hormetic heat stress的研究成果,报道了轻度的热休克会导致秀丽隐杆线虫的寿命延长,且这种现象在未经热刺激的后代中仍然能维持到F5代,并揭示了这种跨代遗传效应被组蛋白H3K9me3和DNA的N6-mA(DNA上的N6-甲基腺嘌呤)的修饰所介导。

为了验证线虫是否存在热压力诱导的生存优势的跨代遗传现象,作者将成年第一天的野生型线虫暴露到35 ℃培养1小时【8】,然后对母体裂解获得F1到Fn代。作者发现热激的亲代和它们的后代(后代正常培养在20 ℃)表现出寿命的显著延长。且这种效应可以一直传递到F5代,即使F1-F4代从未经历过热激,到第六代(F6)恢复正常寿命。此外,热激的雄性与非热激雌雄同体交配,或非热激的雄性与热激的雌雄同体交配,得到的F1子代及其F2代都显示显著的寿命延长,这表明父系和母系均可以传递由热应激诱导的信息,从而导致后代的生存优势(下图)。
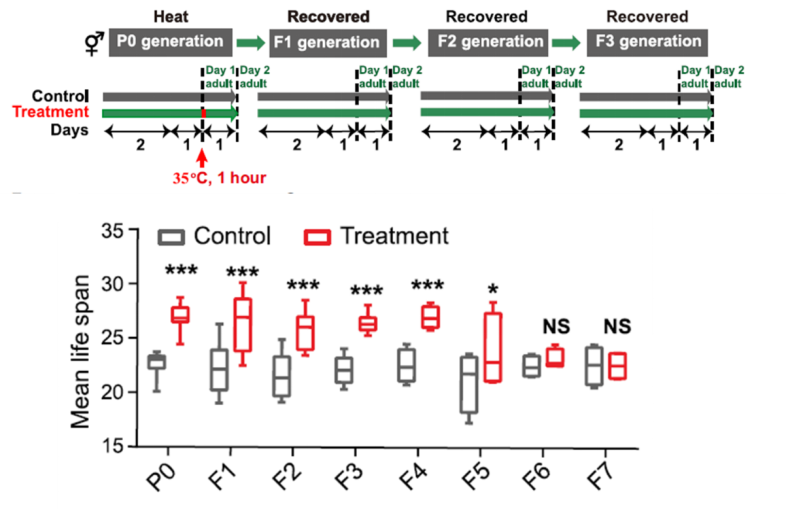
图1. 热应激诱导可跨代遗传的生存优势。
进一步的机制研究发现,转录因子HSF-1、DAF-16和核受体DAF-12参与这种热应激诱导的寿命延长的跨代遗传的调控。为了更明确地分析hsf-1,daf-16和daf-12的作用是执行热应激反应,或是传递可遗传的记忆,还是同时参与两者,作者通过亲代(P0)或者子代(F1)代特异地RNAi沉默分析,发现hsf-1和daf-12在子代中的作用是执行热压力应答去延长寿命,而DAF-16不仅参与执行热应答,还参与跨代记忆的传递。
由于所观察到的热压力诱导的生存优势会在有限世代内恢复到正常水平,作者猜测这一现象可能是受到表观遗传的调控。通过对参与表观遗传调控的部分基因突变株进行检测,发现组蛋白H3K9me3修饰参与该跨代遗传效应。H3K9me3甲基转移酶的set-25和set-32基因的缺失【10】,消除了这种热激诱导存活优势的记忆效应。
除了组蛋白修饰的作用外,DNA甲基化也可以成为可遗传信息的载体【11】。最近的研究表明,DNA N6-mA修饰介导线虫的跨代表观遗传效应【4,12】。作者用dot blot分析,发现DNA的N6-mA修饰在热激的P0代中显著升高,且这种DNA的N6-mA修饰的增加在子代中可一直维持四代,即使子代从未受到任何热激,这一发现与F6代恢复正常寿命一致。此外,N6-mA甲基转移酶功能缺失突变体damt-1(lf)和damt-1(lf)在热应激后均不提高N6-mA的水平。且生存分析发现damt-1突变体消除了热应激记忆的传递。这些结果表明DNA N6-mA修饰参与热应激诱导寿命延长的跨代遗传。
通过采用H3K9me3 ChIP和N6-mA MeDIP技术,作者进一步揭示了H3K9me3和N6-mA这两种修饰在热应激诱导的生存优势的跨代遗传中的调控机制——在热压力下,一些基因的H3K9me3修饰水平降低,同时伴随着N6-mA水平的升高,且这种表观遗传修饰的标记在子代中得以维持,并协同促进应激反应相关基因的转录,最终实现热应激后代寿命的延长。有趣的是,在这项研究中作者发现,在参与热激诱导生存优势的跨代遗传调控的转录因子HSF-1,DAF-16和DAF-12中,DAF-16参与调控热压力诱导的N6-mA升高以传递跨代记忆。
总结来说,这项研究发现父母代可以传递由热休克诱导的信息,从而导致后代的生存受益,使得后代的寿命和健康寿命得以延长。而在这个信息传递过程中,涉及H3K9me3和N6-mA依赖性的跨代遗传网络,这些遗传网络赋予基因表达的改变,最终导致后代的生存优势。这个跨代遗传过程还依赖于转录因子DAF-16和HSF-1以及核受体DAF-12。也就是说,在环境压力下,亲代的热应激会激活DAF-16,HSF-1和DAF-12来延长寿命,而其中DAF-16还调控N6-mA和H3K9me3的水平并在后代中建立这些表观遗传标记。反过来,子代中的H3K9me3和N6-mA标记会促进应激反应相关基因(即daf-16,hsf-1和daf-12,daf-16和hsf-1的靶基因)的募集并促进热应激反应的激活,最终导致由热应激介导的生存优势的跨代表观遗传(下图)。
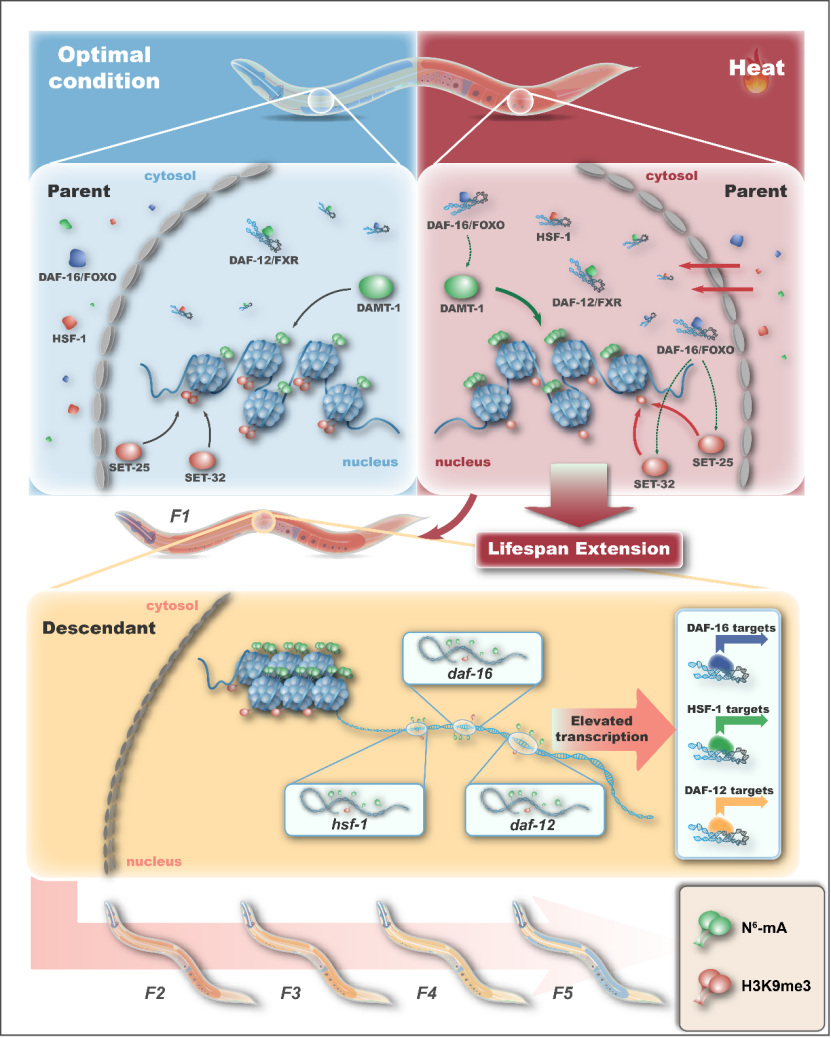
这项研究表征了兴奋性低毒热效应在几代线虫之间的传播,并确定了其传播的相关因素(包括应答热压力的重要因子以及传递环境记忆的表观机制),为进一步了解由热应激介导的后代表观遗传的分子机制提供了框架和研究基础。但在整个研究中,仍然存在一些未解之谜,在整个热激诱导生存优势的跨代遗传中,DAF-16,DAF-12,HSF-1,HLH-30,H3K9me3和N6-mA组成的调控网络是如何整合和协作的,以及表观遗传标记如何逐渐消除和恢复,这些都是将来需要进一步深入研究的机制。
原文链接:
https://advances.sciencemag.org/lookup/doi/10.1126/sciadv.eabc3026
参考文献




 个人中心
个人中心
 我是园区
我是园区




