

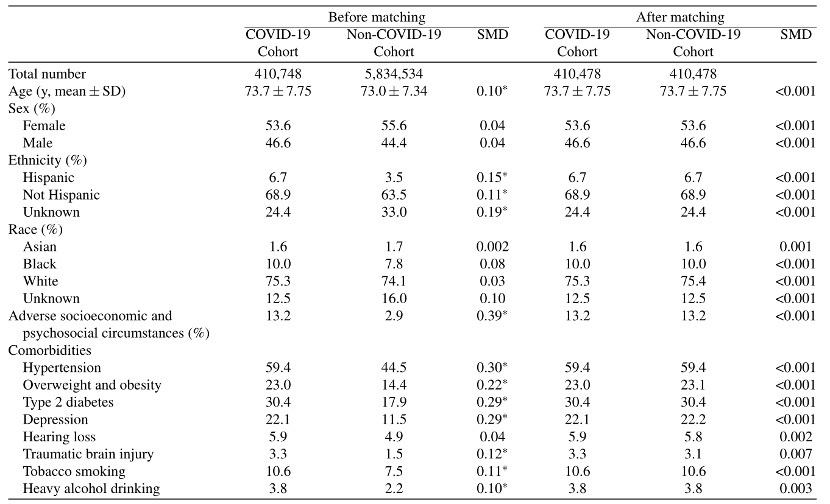
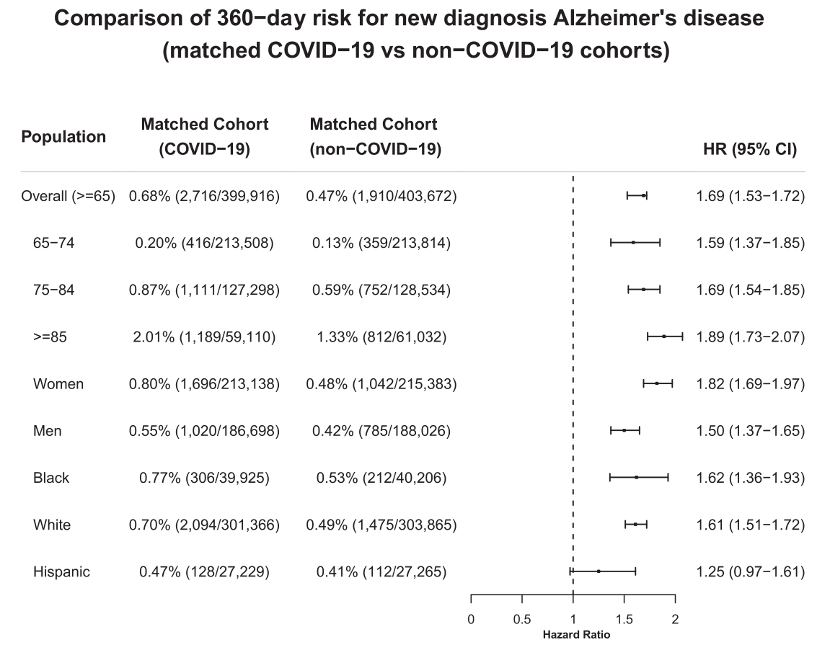
参考资料:
[1]https://news.qq.com/zt2020/page/feiyan.htm#/global
[2]Antonelli M, Pujol JC, Spector TD, Ourselin S, Steves CJ. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2.Lancet. 2022;399(10343):2263-2264. doi:10.1016/S0140-6736(22)00941-2
[3]Púa Torrejón RC, Ordoño Saiz MV, González Alguacil E, et al. Smell and Taste Dysfunction in Pediatric Patients With SARS-CoV-2 Infection [published online ahead of print, 2022 Aug 1]. Pediatr Neurol. 2022;136:28-33. doi:10.1016/j.pediatrneurol.2022.07.006
[4]Saini L, Krishna D, Tiwari S, et al. Post-COVID-19 Immune-Mediated Neurological Complications in Children: An Ambispective Study [published online ahead of print, 2022 Jul 6].Pediatr Neurol. 2022;136:20-27. doi:10.1016/j.pediatrneurol.2022.06.010
[5]Singh Y, Singh SK, Dua K, Gupta G. A molecular study of aryl hydrocarbon receptor activation in COVID 19 associated cognitive impairment - Correspondence [published online ahead of print, 2022 Sep 9].Int J Surg. 2022;105:106895. doi:10.1016/j.ijsu.2022.106895
[6]Arnold C. Could COVID delirium bring on dementia?.Nature. 2020;588(7836):22-24. doi:10.1038/d41586-020-03360-8
[7]Douaud G, Lee S, Alfaro-Almagro F, et al. SARS-CoV-2 is associated with changes in brain structure in UK Biobank.Nature. 2022;604(7907):697-707. doi:10.1038/s41586-022-04569-5
[8]Shi M, Li C, Tian X, Chu F, Zhu J. Can Control Infections Slow Down the Progression of Alzheimer's Disease? Talking About the Role of Infections in Alzheimer's Disease.Front Aging Neurosci. 2021;13:685863. Published 2021 Jul 22. doi:10.3389/fnagi.2021.685863
[9]Baranova A, Cao H, Zhang F. Causal effect of COVID-19 on Alzheimer's disease: A Mendelian randomization study [published online ahead of print, 2022 Aug 30].J Med Virol. 2022;10.1002/jmv.28107. doi:10.1002/jmv.28107
[10]Kehoe PG, Wong S, Al Mulhim N, Palmer LE, Miners JS. Angiotensin-converting enzyme 2 is reduced in Alzheimer's disease in association with increasing amyloid-β and tau pathology.Alzheimers Res Ther. 2016;8(1):50. Published 2016 Nov 25. doi:10.1186/s13195-016-0217-7
[11]Wang L, Davis PB, Volkow ND, Berger NA, Kaelber DC, Xu R. Association of COVID-19 with New-Onset Alzheimer's Disease [published online ahead of print, 2022 Jul 29].J Alzheimers Dis. 2022;10.3233/JAD-220717. doi:10.3233/JAD-220717
[12]Guerrero A, De Strooper B, Arancibia-Cárcamo IL. Cellular senescence at the crossroads of inflammation and Alzheimer's disease.Trends Neurosci. 2021;44(9):714-727. doi:10.1016/j.tins.2021.06.007
[13]Tsuji, S., Minami, S., Hashimoto, R.et al. SARS-CoV-2 infection triggers paracrine senescence and leads to a sustained senescence-associated inflammatory response. Nat Aging 2, 115–124 (2022). https://doi.org/10.1038/s43587-022-00170-7
[14]Yu B, Qi Y, Li R, Shi Q, Satpathy AT, Chang HY. B cell-specific XIST complex enforces X-inactivation and restrains atypical B cells.Cell. 2021;184(7):1790-1803.e17. doi:10.1016/j.cell.2021.02.015
[15]Younan D, Wang X, Gruenewald T, et al. Racial/Ethnic Disparities in Alzheimer's Disease Risk: Role of Exposure to Ambient Fine Particles.J Gerontol A Biol Sci Med Sci. 2022;77(5):977-985. doi:10.1093/gerona/glab231
[16]DOI: 10.1101/2020.02.05.20020107
[17]Ge T, Yuan Y. Herpes Simplex Virus Infection Increases Beta-Amyloid Production and Induces the Development of Alzheimer's Disease.Biomed Res Int. 2022;2022:8804925. Published 2022 Aug 31. doi:10.1155/2022/8804925
[18]Trares K, Bhardwaj M, Perna L, et al. Association of the inflammation-related proteome with dementia development at older age: results from a large, prospective, population-based cohort study.Alzheimers Res Ther. 2022;14(1):128. Published 2022 Sep 9. doi:10.1186/s13195-022-01063-y
封面图来源:123rf


推荐阅读
-
拜登政府要打击中国CXO?看似台风吹过,却只能枝桠微动
-
FDA再「变脸」,药企如何在矛盾中安身立命 -
诺华重组第4步:把从裁员省下的钱,分出3亿美元搞「基建」 -
王明伟/Vogt/杨德华/水雯箐领衔中美科学家深度解析重要靶点PI3Kα的结构与功能
-
FDA批准全球首款Tyk2抑制剂;大反转!FDA专家组7:2支持渐冻症药物AMX0035
-
当PROTAC遇见AI,以创新之利剑高效攻击不可成药靶点!| 晶泰科技·药时代直播间第1期 -
佳节快乐!~~ 100家中国上市药企上市时间汇总暨「药时代高考」模拟卷答案公布! -
生物医药寒冬:不着急、不害怕、不要脸 -
药时代招聘BD专员/经理 | 20多个项目等你来!
-
突发!创始人只得59分!这份药味十足的「药时代高考」模拟卷,究竟有多硬核?
 点击这里,报名参加第三届中国新药CMC高峰论坛!
点击这里,报名参加第三届中国新药CMC高峰论坛!



 个人中心
个人中心
 我是园区
我是园区






