来自:江苏省药监局 编辑:蒲公英-雨轩
2021年6月11日,江苏省药监局发布了药品、医疗器械产品注册收费标准

以下是原文:

江苏省药品监督管理局关于重新发布药品、医疗器械产品注册费收费标准的公告(苏药监规〔2021〕2号)
根据国家有关最新规定和我省《省财政厅 省物价局关于重新发布我省食品药品监督管理部门行政事业性收费项目的通知》(苏财综〔2016〕108号)、《省发展改革委 省财政厅关于降低药品、医疗器械产品注册费收费标准的通知》(苏发改收管发〔2019〕91号)要求,现对目前执行的《江苏省药品监督管理局关于降低药品、医疗器械产品注册费收费标准的公告》(苏药监财〔2019〕7号)进行修订并重新发布。修订的主要事项如下:
一、根据《药品注册管理办法》(国家市场监督管理总局令第27号)第77、79条,省局办理的药品补充申请(含常规项、需技术审评项)已改为备案事项,据此,停征药品补充申请注册费。
二、根据《关于继续免征相关防疫药品和医疗器械注册费的公告》(财政部 国家发展改革委公告2021年第9号),为支持疫情防控,减轻企业负担,对进入医疗器械应急审批程序并与新型冠状病毒(2019-nCoV)相关的疫情防控产品,免征医疗器械产品注册费;对进入药品特别审批程序、治疗和预防新型冠状病毒肺炎(COVID-19)的药品,免征药品注册费。免征期限自2021年1月1日起至2021年12月31日止。
三、根据《市场监督管理行政许可程序暂行规定》(国家市场监督管理总局令第16号)、《国家药监局关于重新发布药品注册收费标准的公告》(2020年第75号),药品、医疗器械产品注册申请人应当在收到《药品注册审批缴费通知书》、《医疗器械注册审批缴费通知书》后15个工作日内按照要求缴纳注册费或提交减免申请,未按要求缴纳或提交减免申请的,其注册程序自行终止。
四、将注册申请人申报小微企业收费优惠政策需提交的资料修订为“上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具);新开办企业,如无上述资料,可提供上一个月的单位社会保险参保缴纳证明(社会保险部门出具)”。
以往规定与本公告不一致的,以本公告为准。
本公告自2021年7月15日起施行。
附件:1.省发展改革委 省财政厅关于降低药品、医疗器械产品注册费收费标准的通知
2.国产药品注册收费实施细则
3.境内第二类医疗器械产品注册收费实施细则
江苏省药品监督管理局
2021年6月8日




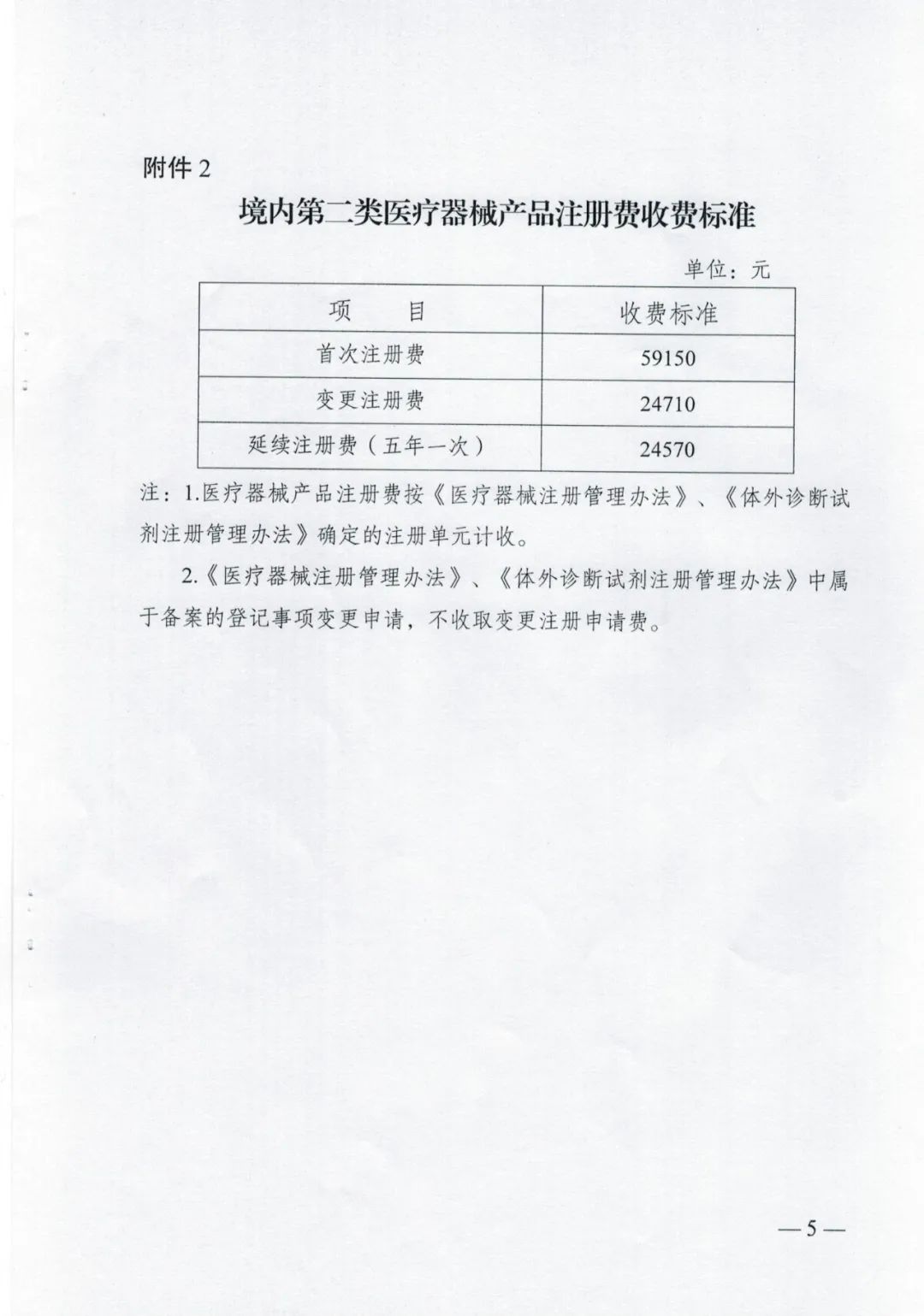
附件2
国产药品注册收费实施细则
依据《药品注册管理办法》(国家市场监督管理总局令 第27号)、《市场监督管理行政许可程序暂行规定》(国家市场监督管理总局令第16号)、《国家药监局关于重新发布药品注册收费标准的公告》(2020年第75号)、《省财政厅 省物价局关于重新发布我省食品药品监督管理部门行政事业性收费项目的通知》(苏财综〔2016〕108号)和《省发展改革委 省财政厅关于降低药品、医疗器械产品注册费收费标准的通知》(苏发改收管发〔2019〕91号)等有关规定,制定本实施细则。
一、药品注册费缴费程序
注册申请人向江苏省药品监督管理局提出申请,江苏省药品监督管理局受理后出具《药品注册审批缴费通知书》,注册申请人按要求缴纳。
二、药品注册费缴费说明
(一)注册申请人应当在收到《药品注册审批缴费通知书》后15个工作日内按照要求缴纳注册费,未按要求缴纳的,其注册程序自行终止。
(二)注册申请受理后,申请人主动提出撤回注册申请的,或江苏省药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
三、退费问题
需要办理退费的,由注册申请人向江苏省药品监督管理局提交书面退费申请,并提供汇款收据、《非税收入一般缴款书》等有关材料,由江苏省药品监督管理局办理退费手续。
附件3
境内第二类医疗器械产品注册收费实施细则
依据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《市场监督管理行政许可程序暂行规定》(国家市场监督管理总局令第16号)、《省财政厅 省物价局关于重新发布我省食品药品监督管理部门行政事业性收费项目的通知》(苏财综〔2016〕108号)和《省发展改革委 省财政厅关于降低药品、医疗器械产品注册费收费标准的通知》(苏发改收管发〔2019〕91号)等有关规定,制定本实施细则。
一、医疗器械产品注册费缴费程序
(一)首次注册申请
注册申请人向江苏省药品监督管理局提出境内第二类医疗器械产品首次注册申请,江苏省药品监督管理局受理后出具《医疗器械产品注册审批缴费通知书》,注册申请人应当按要求缴纳。
(二)变更注册申请
注册申请人向江苏省药品监督管理局提出境内第二类医疗器械产品许可事项变更注册申请,江苏省药品监督管理局受理后出具《医疗器械产品注册审批缴费通知书》,注册申请人应当按要求缴纳。《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于注册登记事项变更申请的,不收取变更注册费。
(三)延续注册申请
注册申请人向江苏省药品监督管理局提出境内第二类医疗器械产品延续注册申请,江苏省药品监督管理局受理后出具《医疗器械产品注册审批缴费通知书》,注册申请人应当按要求缴纳。
二、医疗器械产品注册费缴费说明
(一)注册申请人应当按第二类医疗器械注册单元提出产品注册申请并按规定缴纳费用,对于根据相关要求需拆分注册单元的,被拆分出的注册单元应当另行申报。
(二)按依照法定职责、对辖区内注册申请人提出的境内第二类体外诊断试剂产品注册适用于本实施细则。
(三)注册申请人应当在收到《医疗器械注册审批缴费通知书》后15个工作日内按照要求缴纳注册费或提交《小型微型企业收费优惠申请表》及相关料,未按要求缴纳注册费或提交《小型微型企业收费优惠申请表》及相关材料的,其注册程序自行终止。
(四)注册申请受理后,申请人主动提出撤回注册申请的,或江苏省药品监督管理局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
三、小微企业优惠政策
(一)优惠范围
小微企业提出的境内第二类医疗器械产品首次注册申请,免收其首次注册费。
(二)需提交的材料
对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的注册申请人,申请小微企业收费优惠政策时向执收单位提交下述材料:
1.《小型微型企业收费优惠申请表》(见附表);
2.企业的工商营业执照副本;
3.上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具);新开办企业,如无上述资料,可提供上一个月的单位社会保险参保缴纳证明(社会保险部门出具)。
四、其他问题说明
(一)药械组合产品。药械组合产品以发挥主要作用的物质为准,相应收取注册费。
(二)退费问题。需要办理退费的,由注册申请人向江苏省药品监督管理局提交书面退费申请,并提供汇款收据、《非税收入一般缴款书》等有关材料,由江苏省药品监督管理局办理退费手续。
附表
小型微型企业收费优惠申请表
企业名称: |
统一社会信用代码: |
|
行业类型: |
企业类型: |
|
联系人: |
联系电话: |
|
企业声明 |
从业人员(人): |
|
上一纳税年度营业收入(万元): |
||
企业资产总额(万元): |
||
兹郑重声明本企业属 □小型企业 □微型企业,并保证申报的数据和提交的材料真实有效,如本企业不再符合小型微型企业认定标准,将主动申明。
(公章) 法人代表(签名): 年 月 日 |
||
初审意见:
初审人员: 年 月 日 |
||
核准意见:
审核人员: 年 月 日 |
||



 个人中心
个人中心
 我是园区
我是园区




