1. 基于病毒核酸定量的液滴数字PCR
实时荧光定量PCR方法(Real-time fluorescence quantitative polymerase chain reaction , RT-qPCR)是能够定量检测病毒目的基因扩增数量的PCR技术,目前已经发展成为广泛用于多种病毒检测的技术,具有特异性好,灵敏度高的优点。
液滴数字PCR(Droplet digital PCR, ddPCR)是在RT-qPCR基础上发展出的新技术。两种PCR的原理都是在PCR体系中加入荧光染料或荧光分子标记的寡核苷酸链,在PCR扩增过程中与扩增产物结合并被激发产生荧光,通过荧光信号探测器监测荧光信号的变化来测定目的基因的拷贝数量,反映病毒含量。
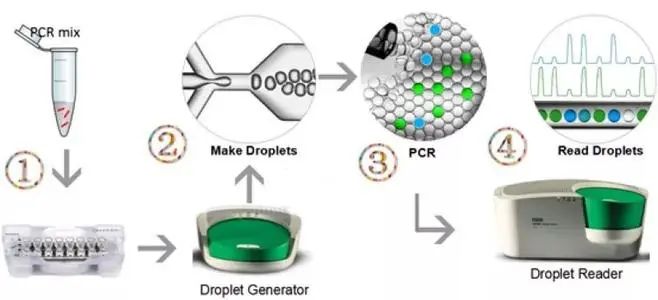
图 ddPCR原理(图片来自网络)
常规RT-qPCR的定量需要采用参照基因的质粒DNA作为标准品,稀释不同浓度后分别作为模板进行PCR,并根据标准品的Ct值和拷贝数来绘制标准曲线,然后将病毒样品所测得的Ct值代入标准曲线获得相应拷贝数,因此定量结果在很大程度上取决于标准物质的质量。而ddPCR检测主要采用微流控或微滴化方法,将大量稀释后的核酸溶液分散至仪器的微反应器或微滴中,使每个反应器中只存在1个或0个核酸模板分别进行PCR。经过PCR循环之后,含有一个核酸分子模板的反应器会检测到荧光信号,没有模板的反应器则没有荧光信号。进一步根据相对比例和反应器的体积,可以推算出原始溶液中的核酸拷贝数。目前ddPCR已经被报道用于慢病毒、新型冠状病毒等,并与RT-qPCR的结果进行比较,结果表明ddPCR具有更高的准确度、灵敏度和重现性,并可以实现真正意义上的绝对定量。
在采用PCR定量检测时,引物的设计,以及RNA病毒的核酸的反转录过程都需要一定的优化和考量,以提高结果的准确性。此外,由于测得的病毒核酸不一定是病毒颗粒的一部分,可能会大大高估存在的病毒数。
2. 基于病毒核酸定量的液滴数字PCR
2.1 高效尺寸排阻色谱法
高效尺寸排阻色谱(High performance size exclusion chromatography,HPSEC)是一种基于尺寸大小分离分子的一种非破坏性技术。HPSEC的色谱基质具有孔穴结构,尺寸大的分子不能渗透到基质孔穴中去而被排阻,较早的淋洗出来;而小分子可完全渗透入内,最后流出色谱柱。HPSEC根据被分离物质的紫外吸收峰面积,对照浓度校正曲线进行定量测定。通过选择不同孔径大小的色谱基质,HPSEC可以实现不同的分离测定。
几十年来,HPSEC已经成为分析抗体等尺寸较小的蛋白质的常用方法,但在病毒的检测中应用相对较少,主要障碍在于HPSEC基质的孔径大小有限,而病毒的尺寸较大,往往会在外水体积被淋洗出来。然而,随着SEC技术的发展,现在已有基质孔径大于100 nm的商业分析柱,从而可以分析大多数大型病毒、病毒样颗粒,以及10-100 nm范围内的聚集体。

图 HPSEC-MALLS分析FMDV及其解聚体【1】
目前HPSEC方法已经成功用于口蹄疫病毒(FMDV)、流感病毒、慢病毒等的定量检测。利用HPSEC定量检测灭活 FMDV,可以在30 min内选择性地检测完整病毒146S,具有很好的重复性和准确性。此外,HPSEC还可与多角度激光光散射(MALLS)探测器耦合,给出HPSEC不同吸收峰物质的平均摩尔质量和平均尺寸,还可计算颗粒数量实现对病毒进行定量,而无需校准曲线。HPLC设备的普及、简单和自动化操作以及HPSEC各种规格的分析柱使其对研究机构、制药公司和监管机构的产品开发或质量监控非常有吸引力。
2.2 场流分级
非对称流场流动分级(Asymmetrical flow field-flow fractionation,AF4)是适用于表征纳米和微米系统的分离技术。与HPSEC不同,AF4不需要分离基质,而是将病毒等样品进样至一个底部为多孔膜的、有连续流的狭窄通道。通过水平方向和垂直方向上的力,在层流方向产生一个抛物线的流速曲线,中间的流速最快,通道的边缘流速最慢。这种形式使得小分子比大分子先洗脱。相比HPSEC,AF4检测更加无损生物样品结构。通过调整进样的时间,层流流速及外场力的大小等参数,AF4可以在很宽的尺寸范围内分离分子(~103-109 Da;粒径从2 nm到0.5-1 μm),因此特别适合病毒和聚集体的分析。

图 AF4-MALLS对流感病毒定量分析【2】
AF4除了根据分离样品的紫外吸收峰面积定量,同样可与MALLS联用,对颗粒数进测定实现对病毒颗粒的定量。Tatiana等采用AF4-MALLS 对细胞培养液中的流感病毒进行定量测定,具有很好的重复性,RSD为1.9%[2]。与其他技术包括HPSEC-MALLS、q-PCR、TCID50等比较,结果具有可比性,证明AF4-MALLS是检测流感病毒的一种可靠技术,具有灵敏度和重复性。与此同时,由于AF4的操作灵活性,对操作人员的专业要求也更高。
2.3 毛细管电泳
毛细管电泳(Capillary electrophoresis,CE)是一类以毛细管为分离通道,以高压电场为驱动力,依据样品组分之间电泳淌度和分配行为的差异而实现分离的新型液相分离技术。其中毛细管区带电泳(Capillary zone electrophoresis,CZE)根据物质在缓冲溶液中表现的荷质比产生不同的电迁移速率,从而进行分离,在具有大尺寸的物质如蛋白质、病毒、病毒样颗粒、脂质体的分析上具有独特的优势。
CZE已被报道分离和测定脊髓灰质炎病毒、人鼻病毒(HRV),并能区分不同血清型的HRV和甲型流感病毒。相比其它检测方法,CZE具有检测速度快的优势。Van Tricht等采用CZE对在不同生产过程中的腺病毒进行定量检测,单个样品的总运行时间最快在5 min以内,30个样品的总运行时间少于4小时,而qPCR为3天。在优化CZE毛细管类型和缓冲液组成后,CZE方法的定量精密度小于5%RSD,准确度为90–110%,测定结果与qPCR等其他方法相当。

图 CZE(A)及HPSEC(B)分别检测多价及二价FMDV抗原。[3]
CZE近期被报道能够实现对多价FMDV疫苗中不同血清型的病毒146S分别定量测定[3]。经分析,FMDV A型与O型抗原存在较大的电荷差异,在CZE中具有不同的保留时间,从而实现良好的分离并能分别定量。而超速离心法与HPSEC均无法区分尺寸相近的两种血清型病毒,因此只能得出总病毒含量。与ELISA方法相比,ELISA难以完全区分完整病毒与亚病毒颗粒,而CZE根据病毒的特征峰可将其与亚病毒颗粒区分开。以上报道显示了CE在病毒定量检测方面的潜力。
3 基于颗粒计数的定量方法
3.1 纳米粒子跟踪分析
纳米颗粒跟踪分析(Nanoparticle tracking analysis,NTA)是利用粒子光散射特性的一种非侵入式和非分离检测技术,可简单、快速地表征直径30-1000 nm的颗粒的尺寸分布和数量密度。其原理是通过显微镜和电荷耦合器件(CCD) 照相机,捕获视野内每个粒子的布朗运动随时间的函数分布图,然后将数据转变为粒子的流体动力直径和粒子浓度。操作简单、检测速度快是NTA的优势,最快可以在5 min内完成检测。
NTA已经应用于慢病毒、外泌体、腺病毒、流感病毒的定量检测。相比其它颗粒检测技术,NTA在定量分析的同时,还可分析所得样品的尺寸分布,提供更多病毒信息。需要注意的是,与HPSEC-MALL相比,NTA对多分散样品,例如未经纯化的病毒样品的表征准确性较差。采用荧光NTA可提高对病毒测定的选择性。
3.2 病毒计数仪(Virus counter, VC)Virus counter
病毒计数仪(Virus counter, VC)是一种类似流式细胞仪,适用于液体样本中的病毒定量的设备,由美国ViroCyt公司开发。其原理是采用两种不同的荧光染料分别对病毒的蛋白质及核酸进行染色。染色后的病毒通过检测室时,被激光激发,被标记的蛋白与核酸分别产生相应荧光信号。通过对同时具有蛋白与核酸荧光信号的病毒颗粒计数进行定量。该检测技术具有分析速度快,样品制备简单的优点。经过30 min左右的染色,VC可在10 min之内,最短5 min完成对带有荧光染料的病毒颗粒分析。VC检测要求病毒尺寸大于25 nm,基因组长度大于9 000 nt/bp,以保证足够的检测信号和可靠的结果。

图 病毒技术仪(图片来自网络)
相比HPSEC-MALLS和NTA,VC作为新技术目前研究相对较少。Stepp等采用VC对一系列病毒包括腺病毒、杆状病毒、冠状病毒、单纯疱疹病毒等进行定量测定,并将结果与TCID50、TEM进行比较,具有较好的相关性。杨小蓉等采用了VC对灭活FMDV疫苗的146S进行定量测定,变异系数为1.15~3.57%,表明结果有较好的重复性。将VC检测结果与超速离心方法进行比较,略有差异但具有一致性,且VC极大的缩短了检测时间。
3.3可调电阻式脉冲传感
可调电阻式脉冲传感 (Tunable resistive pulse sensing,TRPS) 是Izon公司开发的一种实时的纳米颗粒分析技术,能够测量尺寸范围从60 nm到2 μm纳米粒子,适合尺寸较大的病毒分析。对病毒类产品的检测不仅包括纯度分析和定量,最理想的情况下是实时获得更多的病毒性质参数,比如尺寸分布、电荷性、浓度等。TRPS相比其它病毒定量方法,不仅能测得病毒的颗粒数,并能给出样品的粒度分布并同时测定zeta电位,阐明样品的电荷性质[4]。
TRPS已经被用于定量分子慢病毒和轮状病毒等。Ikeda等使用TRPS定量测定了慢病毒载体。结果表明,TRPS所测得的颗粒浓度(7.99×1010 particles/mL)明显高于病毒滴度(1.08×106 particles/mL),但低于RT-qPCR法(2.33×1012 particles/mL)。这一结果也表明不同的病毒定量检测方法之间结果比较的困难。由于慢病毒滴度检测受病毒载体及检测参数的影响,不同实验室及操作方法的检测结果实际上难以互相比较。但基于颗粒分析的技术确实有可能受细胞碎片等干扰物的影响而过高的估计了病毒数量。因此研究者提出经过一定分离方法去除干扰性的杂质后,获得的结果更加准确。
4. 总结与展望
病毒的定量检测对于指导病毒类生物制品的研发和质量控制具有重要意义。目前已有多种基于不同原理的病毒定量检测技术。正是由于检测原理不同,不同的定量检测方法之间往往存在较大差异。例如感染性滴度与总病毒数的结果绝对值相差可达10-1000倍[5]。不同的检测技术各有优缺点,因此在建立病毒定量方法时,需要基于多个因素进行评估,包括对病毒性质的关注点,样品纯度及浓度,方法的准确性、检测速度,仪器成本,方法的可得性等,选择适合本产品的检测技术。值得关注的是,本文介绍的新技术不仅已经在人用疫苗和基因治疗产品的研发中得到应用,ddPCR、HPSEC、VC、CZE等方法也已经在兽用疫苗的检测中崭露头角。相信随着国内疫苗研发和生产水平的提高,这些新技术会越来越多的在疫苗研发中发挥作用。
参考文献
[1]Yang, Y.L., et al., Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens. Vaccine, 2015. 33(9): p. 1143-1150.
[2]Bousse, T., et al., Quantitation of influenza virus using field flow fractionation and multi-angle light scattering for quantifying influenza A particles. Journal of Virological Methods, 2013. 193(2): p. 589-596.
[3]Song, Y., et al., On-line separation and quantification of virus antigens of different serotypes in multivalent vaccines by capillary zone electrophoresis: A case study for quality control of foot-and-mouth disease virus vaccines. J Chromatogr A, 2021. 1637: p. 461834.
[4] 陈思琪,张松平,杨延丽,李贺平,王歈,刘幽燕.慢病毒载体定量检测方法的研究进展[J].生物工程学报,2021,37(07):2283-2292.
[5]Heider, S. and C. Metzner, Quantitative real-time single particle analysis of virions. Virology, 2014. 462: p. 199-206.

识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




