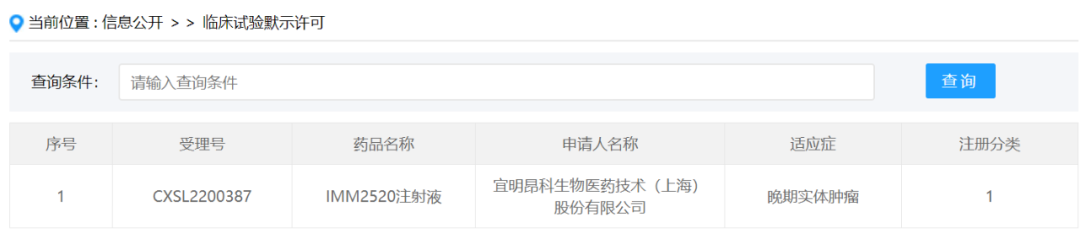
您还不是认证园区!
赶快前去认证园区吧!

CD47是经典的“别吃我”信号,主要通过与巨噬细胞表面的SIRPα结合,释放“别吃我”信号,抑制巨噬细胞的吞噬作用。在所有癌症细胞表面,都能发现存在CD47高表达。这种广谱特性,使得业界认为其在肿瘤领域将大有作为,被业内赋予“PD-1/PD-L1之后的下一个肿瘤免疫领域重要靶点”。
应用前景虽然广阔,但血液毒性一直以来是CD47靶向药临床应用难以规避的安全隐患。曾经Arch Oncdogy、新基等因此相继临床折戟,使得业界普遍对CD47的成药价值产生了质疑。2019年峰回路转,领先玩家Forty Seven的magrolimab凭借亮眼临床数据令大家找回对CD47的开发信心,并重新引领了一批企业入局。
3年过去,CD47的临床开发似乎又进入了瓶颈。今年几个CD47产品临床暂停的消息再度令其成药性受到质疑。
年初,吉利德Magrolimab联合阿扎胞苷临床试验,可疑意外严重不良反应(SUSAR)在各研究组间存在明显的不平衡,被FDA宣布暂停。新的血液毒性的报告使投资者对Magrolimab的未来感到担忧。后来,在对各项临床试验的安全性数据进行综合分析后,magrolimab与阿扎胞苷联合的部分临床试验被FDA解除。再鼎医药在审视CD47竞争格局后,取消了其CD47单抗ZL-1201的II期试验计划,降低在其产品管线中的优先级。艾伯维修订了先前与艾伯维达成的有关Lemzoparlimab达成的19.4亿美元的授权协议,选择终止“Lemzoparlimab+阿扎胞苷+venetoclax”在骨髓增生异常综合征和急性髓细胞性白血病的Ⅰ期临床试验,而把未来寄托在在其他候选CD47抗体药物上。
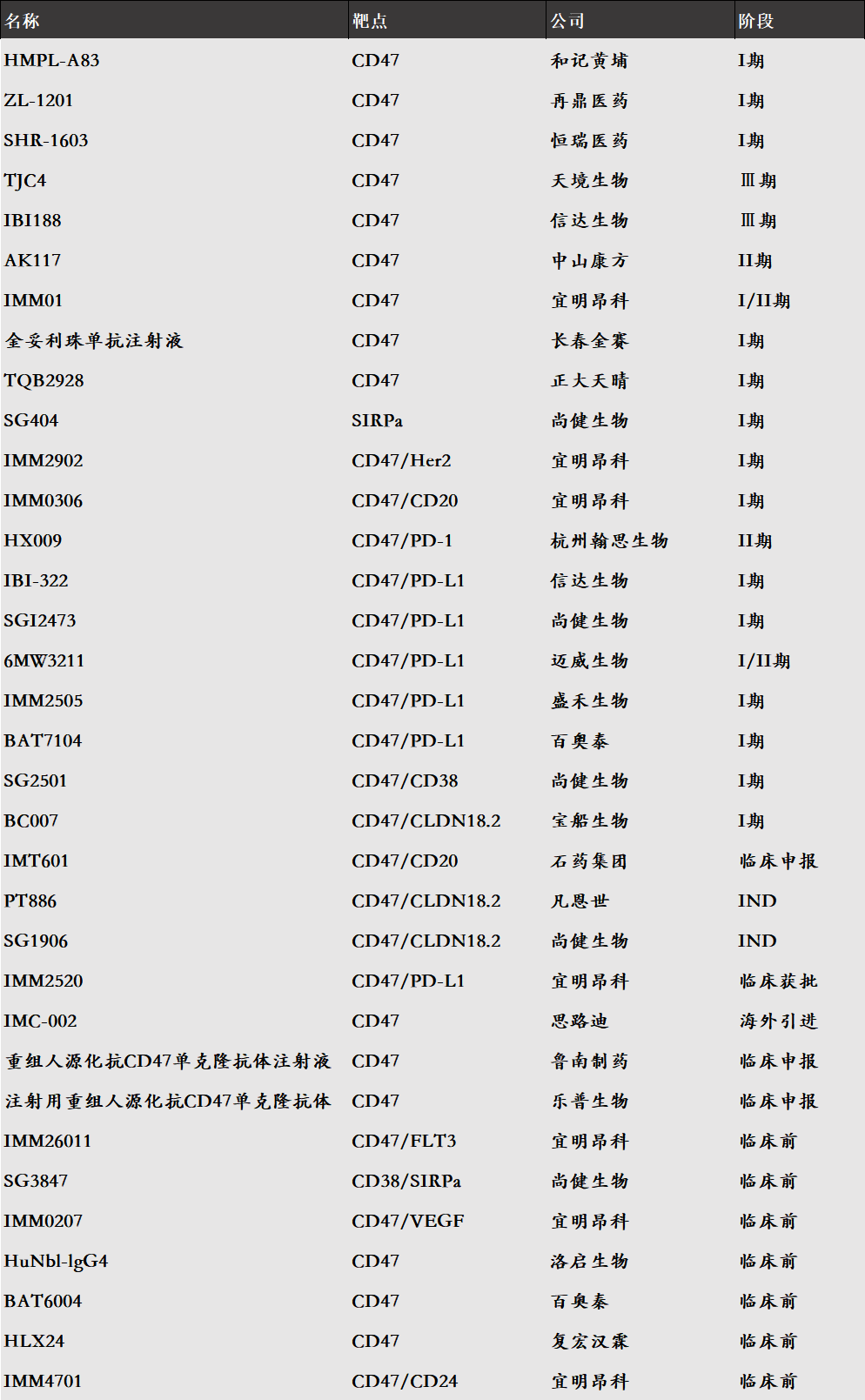
国内有超30款CD47相关产品在研,涉及CD47单抗、CD47双抗,SIRPα融合蛋白、SIRPα抗体、SIRPγ融合蛋白等。
而CD47还在成药性质疑中,宜明昂科布局CD47的决心依旧。目前,宜明昂科为国内拥有临床Ⅰ期以上CD47候选产品最多的药企,除IMM2520之外,宜明昂科的IMM01(CD47单抗)、IMM0306(CD47/CD20双抗)、IMM2902(CD47/HER2双抗)等均已进入临床,还有3款CD47候选人处于临床前阶段。除宜明昂科外,信达生物、科望医药、尚健生物、百奥泰等多家企业有布局2款及以上的CD47候选产品。
1.暂时抽身,再鼎宣布取消CD47单抗推进Ⅱ期临床计划/佰傲云测试
2.艾伯维终止CD47抗体Ⅰ期临床,并与天境达成12.95亿美元新合作协议/佰傲云测试
3,CDE官网,宜明昂科官网




 个人中心
个人中心
 我是园区
我是园区




