▎药明康德内容团队编辑
近日,两款创新药物分别在欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)递交了上市申请,一款用于预防偏头痛,一款用于治疗罕见的遗传性疾病尿素循环障碍(UCD)。
艾伯维(AbbVie)宣布已向EMA提交了其口服降钙素基因相关肽(CGRP)受体抑制剂atogepant(商品名:Qulipta)的营销授权申请(MMA),用于预防每月至少有四天偏头痛发作成人患者的偏头痛预防。该申请如果获批,atogepant将成为欧洲首个用于预防偏头痛的每日口服CGRP受体抑制剂。
偏头痛是一种复杂的神经性疾病。患者会反复出现严重的、抽痛性的头痛,以及极度畏光或声音、呕吐等症状,严重影响日常生活。预估全球有超过10亿人受偏头痛所困扰。慢性偏头痛患者每个月会经历15天或以上的头痛,其中至少有8天有偏头痛的特征。
Atogepant在2021年9月经美国FDA批准用于预防性治疗成人发作性偏头痛,后于2022年6月向FDA提交用于预防慢性偏头痛成人患者的偏头疼发作的补充新药申请。
Atogepant是一种口服CGRP受体拮抗剂。CGRP与其受体表达在与偏头痛病生理学相关的神经系统区域中。研究显示,当偏头痛发作时,CGRP的表达会增加。Atogepant可以通过每日一次的剂量来拮抗CGRP信号。
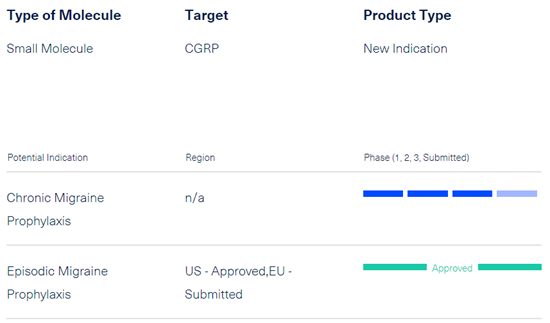
▲
Atogepant的研发进度(图片来源:艾伯维官网)
此次申请是基于两项关键的3期临床研究,分别评估了atogepant在发作性和慢性偏头痛成年患者中的安全性、有效性和耐受性。
在发作性偏头痛研究中,与安慰剂相比,接受atogepant治疗的受试者在所有剂量下月平均偏头痛天数至少减少了50%,并达到了其他关键次要终点。在慢性偏头痛预防研究中,与安慰剂相比,在12周治疗期内,接受atogepant治疗的受试者的月平均偏头痛天数在统计学上显著减少。在两项研究中,atogepant的安全性和耐受性良好,最常见的不良事件是便秘和恶心。
Acer Therapeutics向FDA重新提交Acer-001的新药申请

Acer Therapeutics宣布,已向FDA重新提交用于治疗UCD的口服混悬剂Acer-001(苯丁酸钠)的新药申请。该公司认为这一重新递交的新药申请完整回复了FDA在完整回复函(CRL)中提出的问题。
Acer Therapeutics表示,第三方合同包装制造商已准备好接受检查。此外,FDA并未提出与NDA相关的其他批准问题,也没有要求进行任何额外的临床或药代动力学研究。
尿素循环是主要发生在肝脏中的一系列生化反应,可以将人体内蛋白质和其他含氮分子分解产生的有毒氨转化为尿素排泄。尿素循环必须有6种酶参与,UCD患者由于基因突变会导致其中某一种或两种氨基酸转运酶的缺乏,引起血氨积蓄,进而形成高血氨症。急性高氨血症可导致嗜睡、昏迷和多器官衰竭,而慢性高氨血症可导致头痛、意识模糊、嗜睡、生长迟缓、行为改变以及学习和认知缺陷。
UCD的药物主要由可以绕过尿素循环为氮排泄提供替代途径的氮清除剂组成,目前多为基于苯基丁酸盐或苯甲酸盐的药物,它们可以分别与与谷氨酰胺或甘氨酸偶联,使尿液中的氮变成苯乙酰谷氨酰胺或异丙酸排泄。Acer-001是一种正在开发的氮结合剂,用于涉及氨甲酰磷酸合成酶(CPS)、鸟氨酸氨基转移酶(OTC)或精氨琥珀酸合成酶(AS)缺陷的UCD患者的辅助治疗。除了UCD以外,Acer-001还被开发用于另一种先天性代谢异常疾病,枫糖尿症(MSUD)。
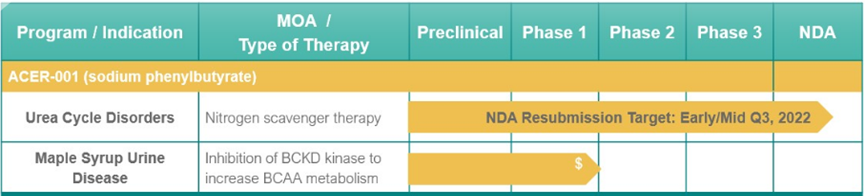
▲Acer-001的研发进展(图片来源:Acer Therapeutics官网)
[1] AbbVie Submits Marketing Authorization Application to EMA for Atogepant for the Preventive Treatment of Migraine. Retrieved July 18, 2022, from https://news.abbvie.com/news/press-releases/abbvie-submits-marketing-authorization-application-to-ema-for-atogepant-for-preventive-treatment-migraine.htm?_ga=2.17183225.1914768820.1658195335-760439082.1658195334
[2] Acer Therapeutics Announces Resubmission of New Drug Application for ACER-001 for Treatment of UCDs. Retrieved July 18, 2022, from https://www.acertx.com/2022/07/18/acer-therapeutics-announces-resubmission-of-new-drug-application-for-acer-001-for-treatment-of-ucds/
[3] Acer Therapeutics官方网站. From https://www.acertx.com/patient_physician/urea-cycle-disorders-ucds/
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。










 个人中心
个人中心
 我是园区
我是园区




