
基于NextPharma全球新药数据库,医药魔方每月定期为大家盘点全球医药交易概况以及新药研发与注册进展重要事件(中英双语版本),报告现已上线医药魔方NextPharma数据库,魔方客户可直接登录账户进入“研究报告”模块下载浏览,非魔方客户可扫码申请订阅每月全球医药交易报告&研发进展报告双月刊,申请方式如下:

【2月全球医药交易概况】

2022年2月全球项目交易共发生68笔,其中涉及国内交易18笔,国外交易50笔;国外交易较为活跃,整体交易趋势基本与往年2月份近似。值得注意的一笔公司收购是:2月16日,Equillium公司宣布收购Bioniz Therapeutics,获得了该公司旗下处于临床开发阶段的潜在“first-in-class”疗法BNZ-1和BNZ-2,这两个先导候选产品是同时靶向经临床验证的多个疾病驱动细胞因子的多特异性抑制剂,旨在解决一系列免疫炎症适应症中未满足的需求。
从交易金额上看,2月份全球项目交易首付款4.64亿美元,交易总金额137.39亿美元;其中涉及国内企业交易的首付款合计为0.58亿美元,国内/全球(首付款)占比12.5%,交易总金额为20.56亿美元,国内/全球(总金额)占比14.96%。
2月份的国内项目交易18笔,海外license in数量有6笔,国内企业之间项目交易有9笔,其中license out交易有3笔:分别是逸达生物和TR-Pharm达成研发合作;复宏汉霖与Getz Pharma就阿达木单抗汉达远达成商业化授权合作;绿叶制药授予Laboratorio Libra 旗下产品Seroquel and Seroquel XR在智利的独家营销权。值得注意的是华东医药在2月份共发生了三笔交易,分别是从Heidelberg Pharma引入4款ADC药物,并以6.44欧元/股的价格认购了35%的股权,成为其第二大股东;与Kiniksa合作引入ARCALYST和Mavrilimumab两款全球创新型自身免疫产品在亚太地区(包括中国、韩国和澳大利亚和其他18个国家,但不包括日本)的独家开发、注册和商业化权益;与美国AKSO 公司合作,获得其在研的全球创新药AB002(用于实体瘤治疗)在亚太地区(除日本)独家临床开发和商业化权益。
华东医药2022年交易事件项目统计

信息来源:医药魔方NextPharma全球新药数据库
2月份海外交易共计50笔,其中涉及技术的交易共计10笔,其余交易项目以创新药为主;比较值得关注的是MNC的大额交易事件,根据披露的数据来看,2月交易事件中总交易金额超过15亿美元的事件有三笔,分别是武田与Code达成了潜在20亿美元合作,开发非病毒载体基因疗法;默沙东与英国公司Curve Therapeutics签署肿瘤和神经学药物发现协议,合作金额超17亿美元;礼来与ImmunoGen合作开发多款ADC新药,总金额同样最高可达17亿美元。
2月海外交易事件项目类型统计

信息来源:医药魔方NextPharma全球新药数据库
下文精选国内外部分重要交易,概览如下:更多交易详情请关注NextPharma数据库交易模块与最新上线的每月交易月报。
国内交易


1. 博雅辑因与Arbor公司达成全球合作,开发体外细胞疗法
交易内容:2月8日,博雅辑因宣布与Arbor Biotechnologies公司达成全球非独占协议,利用后者的CRISPR基因编辑技术,开发针对肿瘤的特定体外细胞疗法。根据协议,博雅辑因将向Arbor公司支付一定金额的首付款、里程碑付款以及相应的销售提成。
Arbor Biotechnologies是一家利用其在机器学习、人工智能驱动的发现平台上研发的基因编辑器,开发下一代基因药物的公司。2016年由CRISPR技术先驱张锋教授、David Walt博士、David Scott博士和Winston Yan博士创立以来,该公司已建立一套基因编辑工具箱,通过发现、筛选和设计新的编辑酶和效应器,针对疾病的根本原因定制开发创新疗法,为患者带来治愈可能。目前,Arbor公司正在向临床推进产品管线,研发重点是肝脏和中枢神经系统疾病。
相关信息:
1)博雅辑因创立于2015年,是一家专注于基因编辑技术转化、处于临床阶段的全球性生物医药公司,致力于研发针对难以根治的遗传病和癌症的创新疗法。据介绍,该公司已建立针对造血干细胞和T细胞的体外细胞基因编辑治疗平台、基于RNA单碱基编辑技术的体内基因治疗平台和致力于靶向药物研发的高通量基因组编辑筛选平台等。
2)2021年11月9日,Arbor 宣布完成2.15亿美元的B轮融资,为在肝脏和中枢神经系统疾病领域的研究提供资金支持。2021年8月24日,Arbor 宣布与 Vertex Pharmaceuticals 签订价值高达12亿美元的合作,Vertex将获得Arbor专有的CRISPR基因编辑技术开发针对糖尿病、镰状细胞病及β-地中海贫血等一系列疾病的基因工程细胞疗法。

2、超9亿欧元!华东医药从德国Heidelberg Pharma引入4款ADC药物;通过股权投资成为其第二大股东
交易内容:2月27日,德国上市公司Heidelberg Pharma宣布与华东医药签署股权投资协议及产品独家许可协议:Heidelberg Pharma授予华东医药两款抗肿瘤ATAC候选药物HDP-101(多发性骨髓瘤)和HDP-103(前列腺癌)在20个亚洲国家和地区的独家开发和商业化权益,和另外两款抗肿瘤ATAC候选药物HDP-102和HDP-104的独家选择权,合作金额最高可达8.1亿欧元。另外,华东医药通过股权投资1.05亿欧元成为Heidelberg Pharma的第二大股东。
通过此次差异化ADC布局,华东医药有望逐步打造ADC领域全球一流的自主研发产业平台,同时加快企业推进创新国际化进程,持续深入布局肿瘤产品领域。
相关信息:
1)鹅膏蕈碱是一种来自有毒的绿色死帽蘑菇双环八肽,是真核转录(RNA聚合酶II变构抑制剂)高效特异抑制剂。鹅膏蕈碱通过抑制DNA转录过程(RNA),不论肿瘤细胞是处于增殖还是静息状态,都能展现抑制活性。这一点,与目前ADC药物中主流应用的MMAE、MMAF、Dxd等不同(仅对增殖状态有效),这种独特的作用机制及不同作用位点又赋予α-鹅膏菌素具有克服耐药性和改善患者预后的潜力。
ATAC技术主要是采用THIOMAB抗体,使用基因工程技术在抗体特性位置插入半胱氨酸残基, 然后将半胱氨酸上的巯基和马来酰亚胺反应,定点偶联至抗体。
Heidelberg较为独特的毒素-鹅膏蕈碱(Amanitin)和相应的偶联技术(ATAC):

来源:Heidelberg Pharma官网
国外交易


1、开发非病毒载体基因疗法,武田与Code达成潜在20亿美元合作
交易内容:2月22日,Code Biotherapeutics公司宣布与武田(Takeda)达成研发协议,两家公司将利用Code Bio的3DNA平台,设计和开发一种用于治疗肝脏罕见病的靶向基因疗法,此外还将进行中枢神经系统罕见病项目的研究。武田有权对四个项目行使独家许可选择权,Code Bio将获得相应的里程碑付款及销售分成,潜在总额高达20亿美元。其中,武田和Code Bio将合作开展研究活动,直至选出候选药物;行使选择权后,武田将负责进一步开发和商业化。
Code Bio旨在开发基因药物来治疗和潜在治愈严重和危及生命的遗传疾病。Code Bio利用其新颖的基于合成DNA的非病毒递送平台3DNA,克服了基于病毒的递送方法固有的许多挑战,包括免疫原性、载荷大小和递送限制、无法重新给药和生产复杂性。
据官网介绍,3DNA平台的设计使这种载体能够实现细胞特异性靶向、大型遗传有效载荷的递送,并具有重复给药的潜力。3DNA已被证明能够递送接近10kb的基因。通过在基于DNA的载体上偶联与特定组织或细胞表面受体结合的配体,3DNA载体可以选择性递送基因药物。3DNA载体的制造简单且可重复,可以实现批量生产和保存。
3DNA平台特点:

来源:Code Bio公司官网
相关信息:
1)2021年10月,武田曾完成一笔类似的交易,在Poseida Therapeutics 的体内基因疗法押注 36 亿美元,用于肝脏和血液疾病的六到八个项目。
2)目前,Code Bio正在推进杜氏肌营养不良症(DMD)等罕见疾病以及以及1型糖尿病(T1D)等自身免疫性疾病项目。2021年4月,Code Bio完成种子轮融资1000万美元。

2、10亿美元!强生与开发RNA编辑的口服小分子疗法Remix Therapeutics达成合作
交易内容:2022年2月17日,生物技术公司Remix Therapeutics宣布与强生公司旗下的杨森制药公司达成战略合作,后者利用Remix的REMaster药物发现平台,发现和开发三款针对免疫和肿瘤的RNA小分子药物。根据协议条款,Remix将获得杨森4500万美元的预付款,在完成各种临床及注册里程碑后,总交易金额高达10亿美元。
虽然蛋白质功能障碍通常是疾病的直接原因,但这种功能障碍的根源往往始于人的遗传密码,伴随着 DNA 的变化和随后的 RNA 表达。Remix 设计针对 RNA 进行编辑的口服小分子药物,在 DNA 转录后、蛋白质生产之前对其核酸及其表达进行微调。有观点认为,靶向 RNA 可以与靶向 DNA 一样有治疗疾病的潜力,但靶向 RNA 的风险可能较小。
Remix 在 DNA 转录后、蛋白质生产之前对其核酸及其表达进行微调:
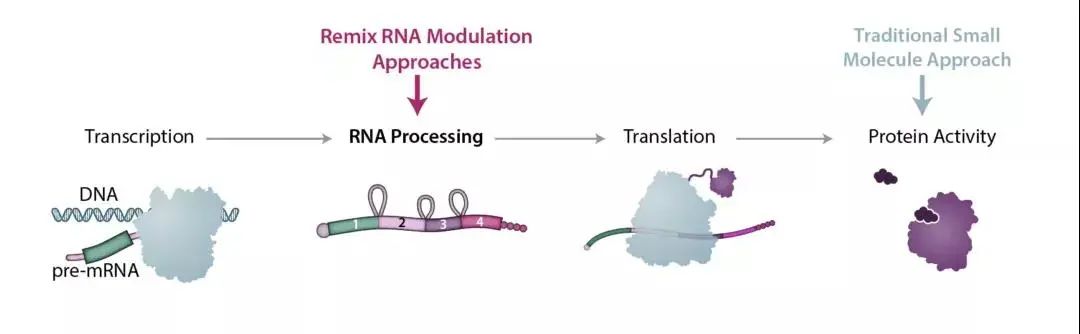
来源:Remix 官网
基于专有的 REMaster技术平台,Remix利用数据分析、高通量筛选技术和下一代化学技术的力量来推进RNA编辑疗法的开发,可以精确地识别和靶向RNA编辑以增强或消除蛋白质功能,或纠正疾病中的蛋白质失调。虽然目前Remix的候选药物还没有进入临床阶段、只获得了体外试验数据,但据透露,这些候选药物有潜力解决包括癌症、中枢神经系统疾病、罕见疾病在内的多种疾病。
相关信息:
1)Remix Therapeutics于2020年12月获得8100万美元A轮融资,资金用于Remix 公司 REMaster 技术平台的开发以及口服小分子 RNA 编辑疗法的开发,以全新的方式治疗疾病。
2)2018 年,Nature 子刊上刊登了一篇来自麻省理工学院 Tasuku Kitada 研究团队的研究成果,他们利用 RNA 编辑实现了一种新的基因疗法,这种疗法可通过人工小分子药物对 RNA 转录进行调控。
在 RNA 翻译成蛋白质这一关键步骤中,一种名为 RNA 结合蛋白(RBP)的蛋白质对整个翻译过程起到至关重要的调控作用,因此,Tasuku Kitada 研究团队筛选出对小分子药物敏感的 RNA 结合蛋白,当小分子药物存在时,RNA 结合蛋白处于激活状态,而当小分子物质不存在时,RNA 结合蛋白处于失活状态。激活状态的 RNA 结合蛋白则会有效与底物 RNA 相互作用,进而调控底物 RNA 的表达。这就相当于用小分子药物为 RNA 装上了 “OFF” 和 “ON” 的开关。
【交易月报一览】

【2月全球新药研发与注册进展一览】

全球新药研发进展报告(中英双语版)由医药魔方制作,该报告专注于收录以下几类重要进展:1)临床结果类:新靶点的 POC/FIRST IN HUMAN 试验结果披露,注册性临床试验结果披露,挑战标准疗法的头对头试验结果披露;2)注册进展类:突破性疗法,FIRST IN CLASS/BEST IN CLASS 产品首次获批等信息,通过该报告可帮助用户清晰回顾每月药品动态,挖掘相关信息,助力企业随时调整发展策略。
根据公开资料不完全统计,截止到 2022 年 2 月 28 日,医药魔方为大家收录到了最近的全球新药重大研发进展共计 14条。其中涉及药物获批上市信息 3 条,临床重大进展 9 条、医药重大交易及特殊审批途径 2 条。
下文选择部分重要信息与大家分享:

1、塞利尼索一线维持治疗晚期或复发性子宫内膜癌的3期试验SIENDO达到主要临床终点
内容:
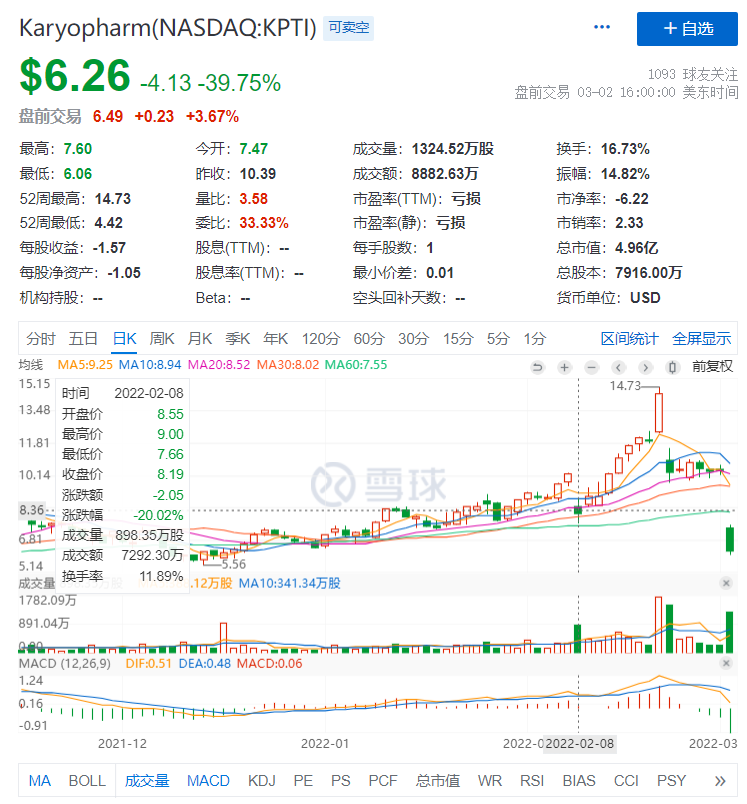
2022年2月8日,Karyopharm公布了塞利尼索治疗晚期或复发性子宫内膜癌的3期试验SIENDO(NCT03555422)顶线数据,该研究评估了口服Selinexor用于晚期或复发性子宫内膜癌一线维持治疗的有效性和安全性。研究结果显示:Selinexor治疗组患者的中位PFS为5.7个月,安慰剂组为3.8个月,显著延长50%;PFS风险比(HR)为0.70 (p=0.0486),疾病进展或死亡风险降低30%。与未接受治疗或仍处于“观察和等待”的患者相比,Selinexor组患者在治疗12个月后无疾病进展可能性增加了37%,显示出持续且稳定的获益。在本研究中,Selinexor耐受性良好,未发现新的安全性信号,且由于不良事件停药发生率低至10.5%。初步数据显示,在p53野生型亚组中(n=103)Selinexor治疗组患者发生疾病进展或死亡的风险明显降低。在该亚组中,Selinexor治疗组中位PFS为13.7个月,安慰剂组为3.7个月,其HR为0.38 (p=0.0006),发生疾病进展或死亡风险降低62%。Selinexor抑制XPO1促使肿瘤抑制蛋白p53在细胞核中累积,使p53能够充分发挥其肿瘤抑制功能。
相关信息:
1. 抑制XPO1可以通过三种机制影响肿瘤细胞:(1) 升高核内肿瘤 抑制蛋白如p53的水平;(2) 将致癌蛋白的mRNA限制在核内从 而减少表达;(3) 维持核内糖皮质激素受体处于激活状态。
2. 塞利尼索抑制XPO1可导致细胞核内p53积聚,借助p53发挥肿 瘤抑制作用。SIENDO试验中,塞利尼索组、安慰组中位PFS 分别为5.7 vs 3.8个月,而在野生型p53亚组中,塞利尼索组、 安慰组中位PFS分别为13.7 vs 3.7个月。
3. 塞利尼索治疗组PFS低于预期,p=0.0486也只是刚刚达到统计学显著差异,消息公布后Karyopharm股价下跌20.02%。

2022年2月10日,SCYNEXIS公布了ibrexafungerp预防复发 性外阴阴道念珠菌病的关键3期试验CANDLE(NCT04029116) 数据。该项III期临床CANDLE研究旨在评估了口服ibrexafungerp相较于安慰剂在260名女性rVVC患者中的有效性和安全性。研究结果表明:治疗24周,ibrexafungerp vs 安慰剂的 临床成功率为65.4% vs 53.1%(p=0.02)。该研究还评估了另外一组24例患者,他们对最初的3天氟康唑治疗方案无效,此后接受为期1天的ibrexafungerp(300mg BID)开放标签治疗。在接受ibrexafungerp治疗的患者中,71%的人成功地显著减轻或消除了症状和体征,安全性方面,ibrexafungerp总体上耐受性良好,无严重的药物相关不良事件发生,也无患者因不良事件停用ibrexafungerp治疗。最常报道的事件是头痛和胃肠道事件,试验达到主要和关键次要终点。SCYNEXIS计划于 2022年上半年向FDA递交ibrexafungerp的sNDA。






 个人中心
个人中心
 我是园区
我是园区













