
责编 | 兮
细胞衰老是机体衰老的重要标志和驱动因素,其中表观遗传改变是细胞衰老的重要特征之一。细胞衰老通常表现为细胞核形态异常、核纤层蛋白结构紊乱以及核周异染色质的缺失。然而,细胞衰老过程中表观基因组的重塑规律以及基因表达改变的调控机制尚不明确。通过系统地绘制细胞衰老过程中不同层次的表观遗传图谱、解析细胞衰老的表观基因组变化规律,有望发现对衰老敏感的表观基因组位点和调控衰老的关键基因,从而为解码细胞衰老的分子机制、揭示预警衰老的生物标志物以及衰老相关疾病的干预靶标提供新的线索。
2022年5月24日,中国科学院动物研究所刘光慧研究组、中国科学院北京基因组研究所张维绮研究组和中国科学院动物研究所曲静研究组合作,于Developmental Cell杂志在线发表题为Large-Scale Chromatin Reorganization Reactivates Placenta-Specific Genes that Drive Cellular Aging 的研究论文。该研究通过深度解析人类干细胞衰老的表观基因组图谱,解码了衰老过程中不同层次表观基因组重塑的规律,发现胎盘相关基因的异常表达是细胞衰老的关键驱动力和分子标志物。该研究加深了人们对衰老程序化的认识,同时也为衰老的科学预警、衰老相关疾病的防治提供了潜在的评估策略和干预靶标。

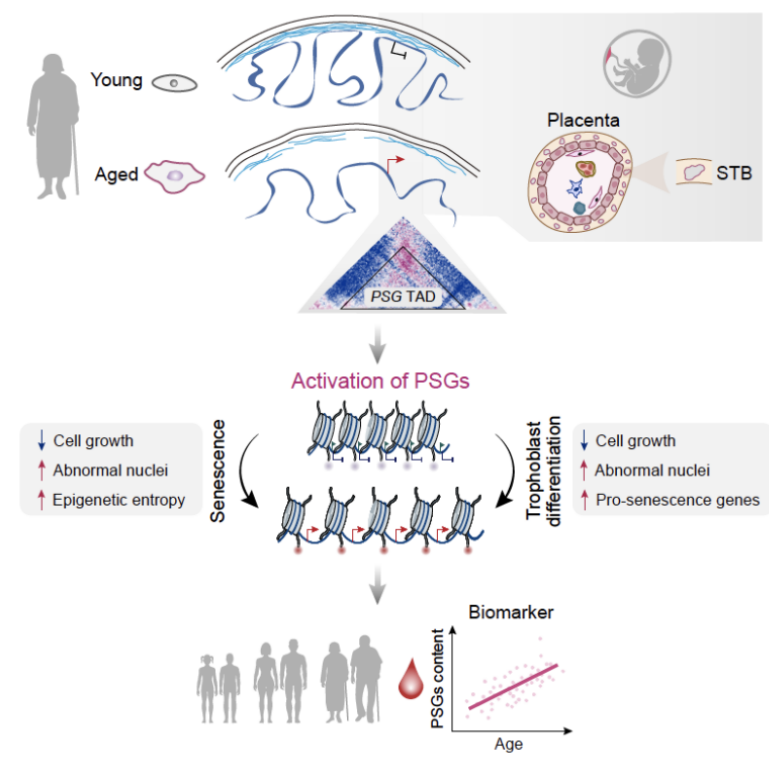
该研究基于团队前期创建的人类干细胞衰老研究体系,综合运用DamID-seq、Hi-C、ChIP-seq(H3K9me3、H4K20me3、H3K27me3、H3K4me3、H3K36me3、H3K27ac、H3K4me1)、ATAC-seq和全基因组DNA甲基化测序(WGBS)等多维技术系统地绘制了人干细胞衰老过程中跨尺度、多层次、高分辨率的表观基因组图谱,以期探究干细胞在复制性衰老、病理性加速衰老过程中表观基因组的重塑规律。该研究深度解析了人间充质干细胞衰老过程中核膜和染色质互作的动态变化、染色质在细胞核中径向分布的大规模重排、染色质高级结构的重塑、精细的染色质状态的转变以及不同层次表观基因组信息的相互作用。研究人员发现衰老细胞的表观基因组呈现出染色质“刚性”的丢失和松弛性增加、表观基因组“熵”和混乱度的增加、“区室化”特征的减弱、全基因组表观信号的趋同性变化和“极性”的降低(激活性基因组区域和抑制性基因组区域表观特征丢失)等规律。研究人员将这种现象定义为“衰老中表观遗传景观的趋同性改变”,即“Convergent Alteration of the Epigenomic landscape during Aging”(CAEA),并首次提出胎盘、发育早期基因以及谱系非必要基因的表观“封印”解除和异位表达是人类细胞衰老的驱动力及分子标记物。
通过对不同层次表观基因组重塑规律的深度解析和整合,该研究揭示了人干细胞衰老过程中表观遗传调控的三个核心特征:
3)对于激活性和抑制性基因组区域的边界,发生了特征性的染色质区室“翻转”和“腐蚀”,具体表现为:边界处更易发生激活和抑制型区室的切换、兼性异染色质信号的丢失以及组成型异染色质和兼性异染色质的隔离“屏障”丢失以及相互入侵。
通过不同层次表观基因组重塑和基因表达特征的整合分析,该研究还建立了衰老细胞中基因组结构性变化和转录表达失调的联系,发现衰老细胞的表观基因组“势能”维持力的降低同衰老伴随的转录失调密切相关,整体激活和抑制性表观遗传特征的丢失和表观基因组的趋同性变化激活了抑制性区域中的谱系/发育特异基因以及多种类型重复元件家族(如:LTR/ERVs等)的异常表达,同时沉默了激活性区域的关键年轻基因(如:细胞周期基因等)的表达。该研究还鉴定出对衰老敏感的表观基因组区域,发现表观基因组的特定拓扑结构和表观状态的改变(与核膜距离趋远、多维表观基因组的去抑制和再激活)会导致位于同一个LAD/TAD中的胎盘发育相关基因簇——妊娠特异性糖蛋白(PSG)的协同激活表达。进一步研究发现,衰老过程中胎盘基因的异位激活是细胞衰老的驱动因素,过表达PSG4(PSG家族成员)可以驱动人类干细胞的衰老。另外,该研究还发现PSG4在老年人血液中的表达丰度显著升高,从而提示PSG4可以作为评估人类机体衰老程度的全新分子标志物。
该研究首次系统地描绘了人干细胞衰老的多层次表观基因组全景图,跨越多个表观基因组维度深入解析了细胞衰老过程中不同层次的表观基因组重塑规律及其与基因表达调控的密切联系。更为重要的是,该研究发现并确定了不同维度表观状态的协同变化所介导的胎盘相关基因PSG4的激活是机体衰老的新型分子标志物,指出了染色质三维结构紊乱所引起的早期发育基因的异常表达是人细胞衰老的驱动力。
总的来说,该研究结合多种衰老模型,提出了细胞衰老的新型表观基因组跨维度变化模式和理论框架,发现了人类衰老的新型标志物和驱动因素。这些发现将为衰老的表观基因组研究提供新的见解,为理解衰老的基因表达调控和关键信号通路提供新的方向,并为开发预防和治疗衰老相关疾病的新型干预靶标提供有力指导。
该研究由中科院动物研究所、中科院北京基因组研究所(国家生物信息中心)、首都医科大学宣武医院、北京医院、中科院上海生科院计算生物学研究所、华中农业大学等机构合作完成。中科院动物研究所刘光慧研究员、中科院北京基因组研究所张维绮研究员和中科院动物研究所曲静研究员为论文的共同通讯作者。中科院动物研究所博士研究生刘尊鹏、季乾昭,中科院北京基因组研究所任捷研究员,中科院动物研究所博士研究生颜鹏泽,中科院动物研究所特别研究助理武泽明和首都医科大学宣武医院王思研究员为论文的共同第一作者。该研究得到中科院动物研究所王红梅研究员、北京医院孙亮教授、华中农业大学曹罡教授以及中科院上海生科院计算生物学研究所魏刚研究员的指导与支持。
原文链接:
https://doi.org/10.1016/j.devcel.2022.05.004
细胞衰老是指一种永久性的细胞周期终止状态,不仅可以促使机体衰老,也可以诱导肿瘤、糖尿病、心血管疾病以及神经退行性疾病的发生发展。越来越多的证据表明,衰老细胞中发生了DNA甲基化修饰、组蛋白修饰、染色质可及性、染色质高级结构等一系列表观遗传的变化。然而,细胞核内不同层级的表观遗传信息交互调控细胞衰老的机制仍然不清楚。
近期,由刘光慧研究员领衔的中国科学院动物研究所和北京基因组研究所的合作团队首次深度解析了人间充质干细胞衰老过程中表观遗传变化的全景图,覆盖染色质一维线性层面的DNA甲基化修饰,染色质二维层面的染色质可及性及组蛋白修饰(H3K9me3、H4K20me3、H3K27me3、H3K4me3、H3K36me3、H3K27ac、H3K4me1),染色质高级结构(A/B区室、TAD拓扑结构域以及染色质环等)。通过系统性组学实验结合生物信息学分析,该团队阐明了人间充质干细胞衰老过程中多维表观遗传信息的动态变化规律,鉴定出了对衰老敏感的新型表观基因组区域。同时,该团队发现可交互作用的多维度表观遗传信息是精准调控基因表达的关键因素。这一发现不仅系统揭示了人间充质干细胞衰老过程多维表观遗传信息的关联调控规律,而且为将来从表观遗传调控的角度来干预衰老提供了重要依据。
发现抗衰老的靶基因是治疗衰老相关疾病的关键一环。该团队通过追踪新型衰老敏感表观基因组区域,发现衰老细胞中发生了拓扑结构域的重排,进而导致11 个妊娠特异性糖蛋白(PSG)基因位于同一个拓扑结构域中,产生协同激活效应,使得这些PSG 基因异常高表达。该研究团队通过进一步的实验揭示过表达PSG4可以加速人间充质干细胞的衰老进程,同时发现PSG4在老年人血液中的表达丰度显著升高,最终证实PSG4可以作为指示衰老程度的重要标记基因,这一令人振奋的发现将为人类衰老相关疾病的治疗提供新的潜在治疗靶点,具有重要的临床转化价值。
衰老是一个极其复杂的生物学过程,通常伴随着机体功能的退化和疾病易感性的增加。随着研究的深入,大家逐步认识到表观基因组重塑是衰老的重要标志。但是,人们对于衰老过程中不同维度表观基因组的重塑模式仍然知之甚少。
为了系统探究干细胞衰老过程中表观基因组的重塑规律,中科院动物所刘光慧研究员领衔的合作团队基于前期建立的间充质干细胞衰老模型绘制了丰富的、精细的、多维的表观基因组图谱(包括基因组空间构象、组蛋白修饰、染色质开放性、DNA甲基化等)。通过深入解析人间充质干细胞衰老过程中不同层级染色质的空间定位和结构以及染色质状态的转变,研究人员发现衰老细胞的一个典型特征是染色质组织和表观遗传修饰的“熵增”和“躺平”,也就是激活和抑制型基因组区域表观特征均发生丢失,进而呈现出趋同的变化。
更为重要的是,这项研究发现表观基因组的“躺平”和转录失调密切关联,发现抑制型区域内表观基因组的去抑制异常激活了发育基因或者其他的谱系基因,而激活基因组区域内活性的降低则与细胞周期等年轻化因子的表达抑制相关联。有趣的是,该研究发现在衰老敏感的基因组位点,不同层级的表观遗传重塑协同激活了处于一个TAD内部的胎盘发育基因的集合——妊娠特异性糖蛋白PSG基因家族,并证实了PSG的活化是衰老的重要驱动力和新型生物标志。
总之,这项研究利用多种干细胞衰老模型,结合多维表观基因组研究技术,绘制了多层次的表观调控图谱,并对人类干细胞在衰老过程中不同层级染色质结构和表观遗传修饰的重塑模式进行了迄今为止最为全面和详细的描述,首次提出了热力学第二定律在细胞核及染色质结构上的“混乱度增加”的表现形式。此外,该研究首次提出了胎盘相关基因的异位活化是人类细胞衰老的重要驱动因素及新型分子标记物,极大丰富了衰老研究的理论基础,同时为衰老和衰老相关疾病的科学评估和干预提供了潜在着力点。
表观遗传的改变是衰老的一个重要标志。虽然近十年来,人们对衰老细胞的组蛋白修饰和DNA甲基化等表观遗传学特征做了部分的描绘,但是受到技术手段和实验规模的限制,目前仍然缺少一个全局性的以及系统性的对衰老过程中表观基因组的各个层级之间相互关系和组织变化精细刻画的研究。
最近,来自中国科学院动物研究所刘光慧课题组、北京基因组研究所张维绮课题组和动物研究所曲静课题组的合作团队填补了这一空白。以正常衰老和早衰的人间充质干细胞为模型,该团队首次绘制了高分辨率的衰老细胞表观基因组全景图,描绘了衰老过程中从染色质层关联域、染色质区室,到拓扑结构域、染色质环,再到染色质状态和基因转录组等各个层级中三维结构和相互作用的动态变化,以及层级间的交互关系。该团队首次揭示了衰老导致的表观基因组重塑具有显著的“去极化”特征,在全局表观基因组层面表现为“熵”值的增加;在三维空间结构层面表现为基因组区域内部抑制或激活特性的减弱,边界区域抑制和激活特性的不稳定与相互转换;在染色质状态和基因调控层面则表现为染色质抑制或激活相关修饰的丢失和基因转录紊乱。
除此以外,通过对染色质三维结构失调区域的基因表达进行分析,该团队还发现,曾在胎盘中特异表达,随后在年轻个体中沉默的PSG蛋白家族会在衰老的细胞中再次激活。对老年人队列研究的血液样品数据分析进一步确证了PSG家族可以作为人类衰老进程的生物标志物。有趣的是,PSG家族的全部11个成员位于同一个拓扑结构域内,因此在衰老引起的表观基因组重塑过程中被协同调控。另外,在年轻细胞中异位表达该家族成员PSG4,可以诱导产生一系列衰老相关表型,揭示了 PSG4是细胞衰老的一个驱动基因。
刘光慧研究员领导的这一突破性成果,解码了衰老过程中表观基因组重塑的基本模式,并为今后的衰老研究提供了一份完整的表观基因组学参考数据集和研究框架。这项工作加深了我们对表观遗传在衰老中作用的理解,为衰老和相关疾病的早期诊断和预防打开了新思路,并为将来设计延缓甚至逆转衰老的策略提供了理论基础。

转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




