▎药明康德内容团队报道
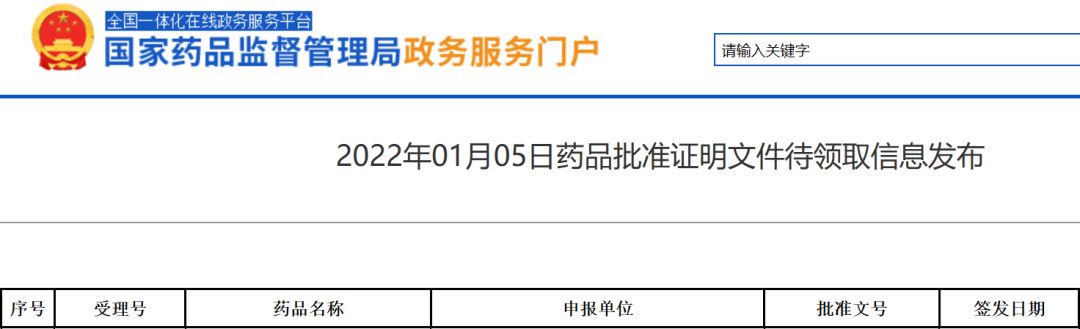
中国国家药品监督管理局(NMPA)官网最新公示,百济神州抗PD-1抗体替雷利珠单抗(百泽安)的一项新适应症上市申请已获得批准。公开资料显示,这也是替雷利珠单抗在中国获批的第6项适应症,
具体为:
治疗接受铂类化疗后出现疾病进展的二或三线局部晚期或转移性非小细胞肺癌(NSCLC)
患者。
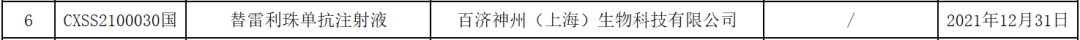
替雷利珠单抗是一款人源化lgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的是为最大限度地减少与巨噬细胞中的Fcγ受体结合。临床前数据表明,抗PD-1单抗与巨噬细胞中的Fcγ受体结合之后,会激活抗体依赖的细胞介导的吞噬作用(ADCP效应),从而杀伤T细胞,降低抗PD-1抗体的抗肿瘤活性。
2021年1月,百济神州已与诺华公司(Novartis)达成合作,将在北美、欧洲和日本等地区共同开发、制造和商业化
替雷利珠单抗
。
此前,替雷利珠单抗已在中国获批5项适应症,包括完全批准用于:1)联合化疗用于治疗一线晚期鳞状NSCLC患者;2)联合化疗用于治疗一线晚期非鳞状NSCLC患者。附条件批准用于:3)至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(cHL)患者;4)PD-L1高表达的含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌(UC)患者;5)至少经过一种全身治疗的肝细胞癌(HCC)患者。
根据
百济神州早前新闻介绍,替雷利珠单抗此次获批
的新适应症上市申请,
基于一项名为RATIONALE 303的全球3期临床中期分析结果。这是一项随机、开放性、多中心的全球3期临床试验,旨在评估替雷利珠单抗对比多西他赛用于治疗接受铂类化疗后出现疾病进展的二线或三线局部晚期或转移性NSCLC患者的有效性和安全性。
根据百济神州在2021年美国癌症研究协会年会(AACR)上公布的数据,研究达到了意向治疗患者人群(ITT)总生存期(OS)的主要终点。在ITT人群中,治疗组的中位OS为17.2个月,显著高于对照组的11.9个月;在PD-L1高表达患者中,治疗组的中位OS为19.1个月(vs 11.9个月)。此外,替雷利珠单抗组的中位无进展生存期(PFS)为4.1个月(vs 2.6个月),在12个月时的PFS概率为23.3%(vs 5.7%),客观缓解率(ORR)为21.9%(vs 7.0%),中位缓解持续时间(DoR)为13.5个月(vs 6.2个月),均明显高于对照组。
众所周知,肺癌无论是在全球范围还是在中国,其发病率和死亡率都高居不下。肺癌分为非小细胞肺癌和小细胞肺癌(SCLC),其中NSCLC占了80%-85%。百济神州的临床研究
表明,
替雷利珠单抗对比化疗能够改善那些接受化疗后出现疾病进展的晚期NSCLC患者的总生存期。
希望替雷利珠单抗此次获批这项新适应症,能够为中国二或三线非小细胞肺癌患者带来新的治疗选择。
[1]中国国家药监局1月5日药品批准证明文件待领取信息. Retrieved Jan 5,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220105143701157.html
[2]百济神州宣布百泽安(R)针对二或三线非小细胞肺癌的新适应症上市申请在中国获受理. Retrieved Mar 05,2021, from https://www.prnasia.com/story/310522-1.shtml
[3]百济神州在美国癌症研究协会(AACR)2021年年会上公布百泽安(R)用于治疗二线或三线非小细胞肺癌的 RATIONALE 303 临床试验中期分析结果. RetrievedAprc 13,2021, from https://www.prnasia.com/story/314732-1.shtml
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。







 个人中心
个人中心
 我是园区
我是园区




