
粘附类G蛋白偶联受体
(
aGPCR
)
是G蛋白偶联受体
(GPCR)
超家族中的一类,在神经、免疫和心血管系统中起着至关重要的作用,与生殖、神经发育或神经行为障碍、肿瘤等疾病直接相关。aGPCR家族的一个独特特征是在跨膜结构域之前的受体胞外侧存在可以发生自水解的GPCR蛋白酶自水解诱导
(GAIN)
结构域,其中包含保守的GPCR水解位点
(GPS)
。在配体结合、蛋白相互作用或机械刺激下,aGPCR在GPS位点发生自水解,并产生细胞外区域
(NTF)
和七次跨膜螺旋区域
(CTF)
两个片段,其中在CTF的 N端的十几个氨基酸被称为栓系肽段
(stalk peptide)
,可以作为激动剂进入受体跨膜结构域,将受体激活并招募下游G蛋白,这就是“栓肽”自激活模式,被认为是aGPCR激活的主要机制。此前,GAIN结构域的结构已经得到解决,但作为信号级联关键启动子的aGPCR跨膜域的结构信息却十分有限,导致aGPCR的自激活机制尚不明确。
2022年10月28日,哈工大生命科学中心何元政课题组在Molecular Cell上发表了文章
Structural insights into adhesion GPCR ADGRL3 activation and Gq, Gs, Gi, G12 coupling
(粘附类G蛋白偶联受体蛛毒素受体3和Gq,Gs,Gi,G12偶联的激活结构研究)
,
解析了粘附类G蛋白偶联受体蛛毒素受体3 (ADGRL3) 与全部四种主要G蛋白复合物的冷冻电镜结构,阐明了粘附类G蛋白偶联受体特殊的配体结合方式、独特的激活构象和关键的激活机制,并揭示了不同G蛋白偶联选择性的结构基础。
粘附类G蛋白偶联受体蛛毒素受体3
(ADGRL3)
对突触的形成和强化至关重要,并与注意缺陷多动障碍和多巴胺信号失调等相关疾病有关。何元政课题组首先通过功能和生化研究,发现ADGRL3能够激活全部四个主要的G蛋白信号通路,并得到了ADGRL3与Gq,Gs,Gi,G12复合物的冷冻电镜结构,分辨率分别为2.75Å,2.8Å,2.97Å和2.93Å。结构分析及功能数据表明,stalk peptide与受体的结合主要是通过疏水作用介导的,且这种结合方式在aGPCR家族中是保守的;自激活的ADGRL3具有不同于A类GPCR的独特激活构象,跨膜螺旋6
(TM6)
中间部分发生由四个关键残基L11536.48,L11546.49,G11556.50和L11566.51介导的剧烈弯曲扭转
(图1左)
,跨膜螺旋7也存在较大程度弯曲,同时跨膜螺旋1、2之间距离显著增加;进一步研究发现TM6的急剧弯曲可能是受体激活的关键,当stalk peptide进入配体结合口袋,其FLM基序与受体上的残基F11767.42和W11586.53相互作用,使TM6的N端部分解螺旋形成弯折,并将信号传递至M10262.47,形成疏水相互作用网络“五核”
(penta-core)
,从而稳定活性构象,最后将激活信号传递给与可Gα的αH5形成直接接触的残基R9772.46和L10333.54,进而激活G蛋白下游信号通路,形成一条完整的信号传导链
(图1右)
。该研究首次揭示了G12偶联复合物的结构信息,发现其主要通过疏水相互作用介导与受体的结合。
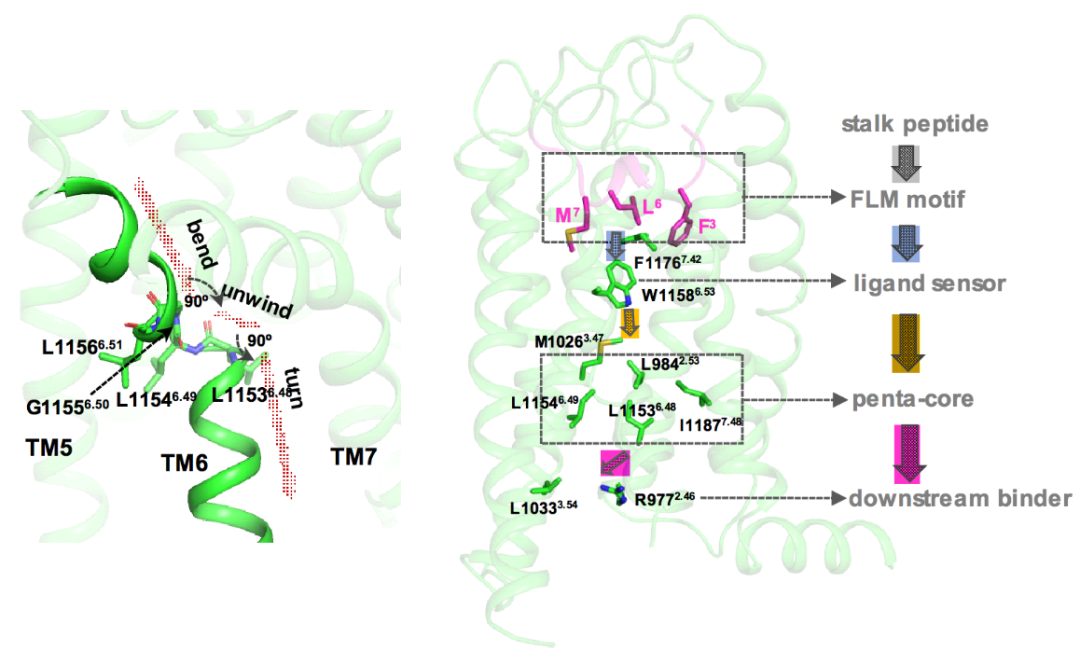
图1左:LLGL基序介导的TM6“弯曲-解旋-扭转”构象是受体激活的关键;图1右:ADGRL3自激活过程示意图
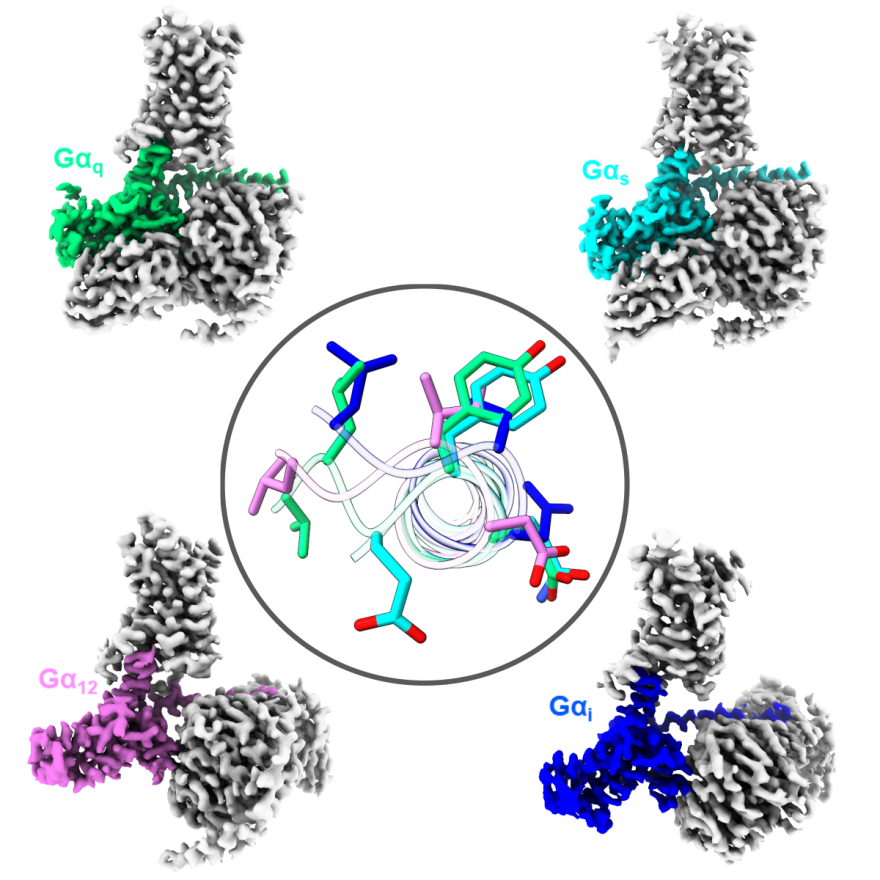
同时,该项研究首次对同一个受体上的4种主要的G蛋白的偶联方式进行了详细的比较。结构比较发现G蛋白的偶联的专一性主要有Gα亚基的C端第5螺旋
(αH5)
的最后7个氨基酸残基决定,并且这4种主要的G蛋白的偶联的方式大体可以分成两类,1)Gq和Gs主要以极性相互作用为主,结合最显著的特征是倒数第4位的酪氨酸(Y-4)插入受体腔中心并与受体内核附近的极性残基相互作用;2) Gi和G12则是主通过疏水作用与受体结合,具体表现为αH5的末端亮氨酸残基与受体的穿模区的3,5和6螺旋间的一个强疏水区的相互结合。这其中G蛋白倒数第4位的酪氨酸是区别两类作用的分水岭
(图2)
。根据这些结构信息,何元政课题组研究人员发现第1036和1114位的苯丙氨酸
(M1036, M1114)
在区别两类偶联方式种起重要作用。将M10363.57和M11145.61突变为丙氨酸后,选择性地增强了Gq/s信号,而对Gi和G12信号没有影响,并且这种G蛋白信号选择性的增强现象在更为接近生理条件下,比如MCF-7细胞和老鼠肝实质细胞上,也得到了验证,这为理解G蛋白偶联选择性和偏向性配体的设计提供了理论基础。值得一提的是,该项研究是对年初同期4篇Nature粘附类G蛋白偶联受体文章的重要补充,该研究着重于不同G蛋白偶联的具体机制和选择性的结构基础,将进一步丰富对粘附类G蛋白偶联受体信号途的理解。
何元政课题组博士生钱雨为本论文第一作者,何元政课题组马正雄、祝鑫焱、王娜、徐珍媚、夏瑞雪、梁佳乐、段亚宁、尹晗、熊杨杰及生命科学中心陈政课题组刘春红、李新志合作参与了该项研究工作。何元政研究员为本文的通讯作者。
原文链接:
https://doi.org/10.1016/j.molcel.2022.10.009
制版人:十一

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。












 个人中心
个人中心
 我是园区
我是园区





