据 Insight 数据库统计,本周(4.18 - 4.23)国内共有 45 款创新药研发进度推进到了新的阶段,包括 1 款新获批上市,1 款申报上市,3 款进入到 III 期临床开发,12 款首次启动临床,23 款首次获批临床。
化药仍旧占大头(25/45),不过本周基因治疗(3)成为了化药之后的第 2 位,3 个项目进展至新的阶段;溶瘤病毒也有 2 个项目在本周有了新进展。Insight 将摘取部分重点项目做介绍。
本周发生变化的创新药在研进度分布

来自:Insight 数据库 项目进度可视化(http://db.dxy.cn/v5/home/)
兆科药业引进抗肿瘤新药获批上市
周四,NMPA 发布批件批准了兆科药业引进的新药 盐酸丙卡巴肼胶囊 。这是一款烷化剂药物,用于治疗霍奇金淋巴瘤及部分脑癌(例如多形性胶质母细胞瘤),本次在国内的获批适应症为晚期霍奇金淋巴瘤。
盐酸丙卡巴肼胶囊(Procarbazine Hydrochloride)最初由罗氏(Roche)研发,1969 年已在海外获批上市,由 Leadiant Biosciences(前身为 Sigma-Tau 公司)生产。李氏大药厂全资附属公司于 2018 年 5 月与 Leadiant 公司签署经销协议,以推进盐酸丙卡巴肼胶囊在大中华地区独家上市。2020 年 5 月,盐酸丙卡巴肼胶囊的上市申请获 CDE 受理。
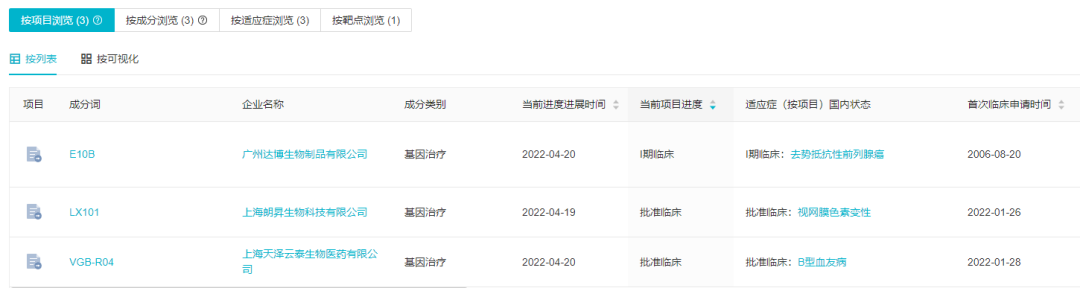
14 款新药首次启动临床
1、翰森制药:两款新药首次启动临床
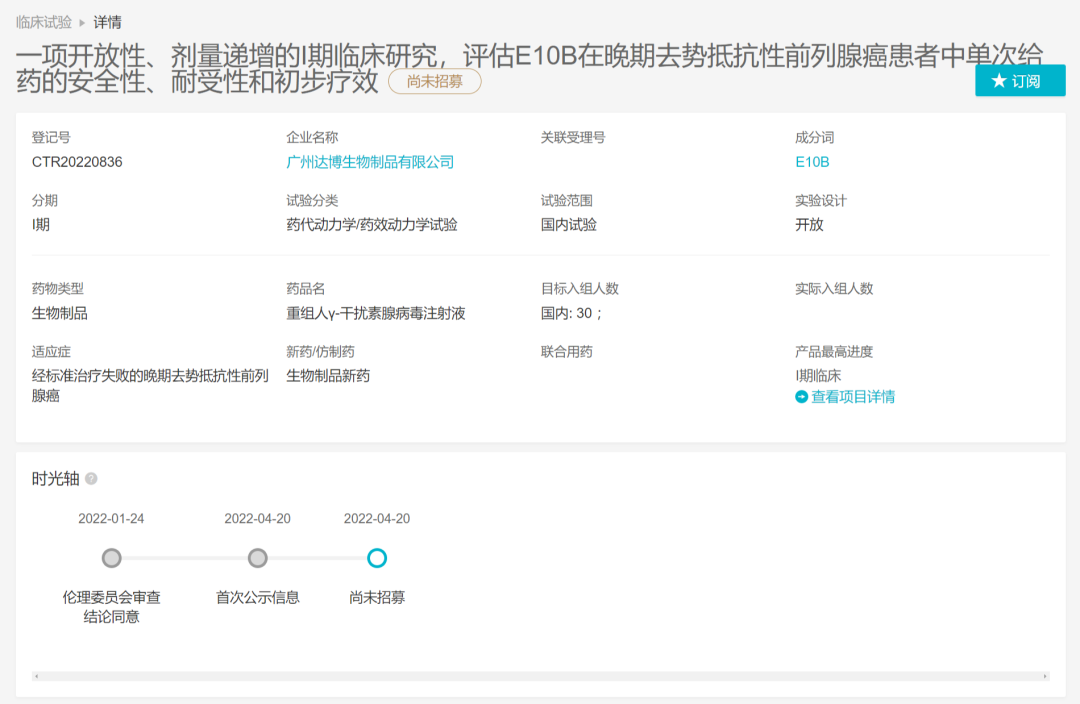
据 Insight 数据库,本周翰森制药启动了两项临床试验,分别涉及 1 类抗肿瘤新药 HS-10381 和引进抗真菌药物 HS-10366(Ibrexafungerp)。这两款药物均为首次启动临床。
Ibrexafungerp 是 20 多年来首个全新作用机制的第四代抗真菌类药物,已于 2021 年 6 月获 FDA 批准,用于治疗霉菌性阴道炎。该药由美国 SCYNEXIS 公司开发,具有广谱抗真菌活性,具有口服和注射两种剂型方便使用,治疗多种真菌引起的院内及院外感染。
2021 年 2 月,翰森制药以 1000 万美元首付款 + 潜在里程碑款及提成获得了 Ibrexafungerp 在中国的开发、监管批准和商业化权益。同年 12 月,Ibrexafungerp 片在中国获批临床,并于本周启动了 III 期临床试验,针对外阴阴道念珠菌病(VVC)。
HS-10366 项目概览

来自:Insight 数据库 项目进度(http://db.dxy.cn/v5/home/)
HS-10381 则在 2021 年 10 月首次获批临床,目前其靶点尚未披露。

来自:Insight 数据库 项目进度(http://db.dxy.cn/v5/home/)
此外,翰森制药的创新药研发正在不断提速中,今日又有一款新药 HS-10384 首次获批临床,用于更年期血管舒缩综合征。

来自:CDE 官网
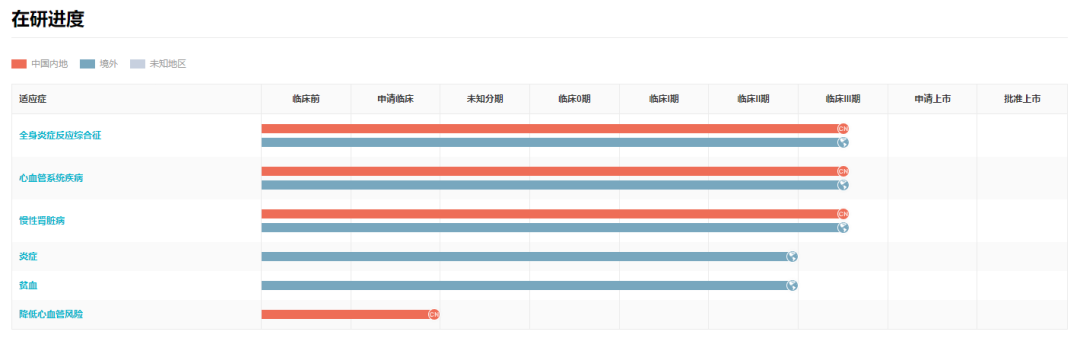
2、超 21 亿美元获得,诺和诺德「泽韦奇单抗」国内启动临床
泽韦奇单抗(Ziltivekimab)是一款全人源单克隆抗体,通过抑制 IL-6 来减少全身炎症。该药经过长效化改造以延长半衰期,仅需每月一次皮下注射给药。
诺华对泽韦奇单抗寄予厚望。2020 年 6 月,诺和诺德以 7.25 亿美元首付款、潜在总额超 21 亿美元收购了阿斯利康子公司 Corvidia Therapeutics。该公司专注于心脏和肾脏疾病治疗药物的开发,泽韦奇单抗就是其主要候选药物,用于降低慢性肾病(CKD)患者的主要心血管不良事件(MACE)风险。
据 Insight 数据库,目前泽韦奇单抗全球正处于 III 期临床开发阶段,国内则在本周首次在 CDE 登记了 I 期临床,针对慢性肾脏病合并系统性炎症患者。
泽韦奇单抗全球适应症开发进度


 Insight 小程序
Insight 小程序
 戳此领取试用福利,解锁更多新功能!
戳此领取试用福利,解锁更多新功能!



 个人中心
个人中心
 我是园区
我是园区




