
中性粒细胞是人体血液中含量最多的免疫细胞,以往通常认为中性粒细胞作为一种均质性的细胞参与了机体的抗感染免疫反应,而近年来的研究发现中性粒细胞具有丰富的异质性,中性粒细胞既能表现出免疫促进的N1表型又能表现出具有免疫抑制的N2表型,异质性的中性粒细胞在天然免疫反应和适应性免疫反应中均发挥了重要作用,但目前介导中性粒细胞免疫异质性的机制尚不清楚。
2021年1月8日,上海交通大学医学院附属仁济医院上海市肿瘤研究所张志刚团队与上海交通大学医学院附属仁济医院胆胰外科孙勇伟团队合作在Nature Communications杂志(2019年影响因子12.121,5年影响因子13.61)在线发表了题为“Identification of a subset of immunosuppressive P2RX1-negative neutrophils in pancreatic cancer liver metastasis”的研究论文。

该研究发现了胰腺癌肝转移免疫微环境中富含ATP受体P2RX1阴性(P2RX1-)的中性粒细胞,而正常肝脏中以P2RX1阳性(P2RX1+)的中性粒细胞为主。P2RX1-和P2RX1+中性粒细胞表现出了代谢和免疫学表型的异质性,P2RX1-中性粒细胞线粒体代谢增强,高表达PD-L1、Arg1等免疫抑制分子;P2RX1+中性粒细胞糖酵解代谢增强,高表达TNF-α、IL1-α等免疫促进分子。胰腺癌肝转移微环境中的P2RX1-中性粒细胞过表达PD-L1,抑制了杀伤性CD8+T细胞的细胞毒活性,运用PD-L1或者PD-1单抗均有效恢复了杀伤性CD8+T细胞的细胞毒活性。机制研究表明,P2RX1-中性粒细胞高表达转录因子Nrf2,Nrf2介导了P2RX1-中性粒细胞代谢表型和免疫表型的转变。

研究结果

为了研究胰腺癌肝转移过程中免疫微环境的变化,作者对数据库中胰腺癌原位、癌旁、肝转移和转移旁4个组织的大体切割标本进行了转录组分析。差异分析结果显示不同组织之间转录组改变明显,为了进一步探讨免疫微环境的差异,作者对26种免疫细胞图谱进行了分析,结果显示各个组织中免疫细胞图谱差异明显,其中肝转移组织中参与抗肿瘤免疫的activated CD8+、central memory CD8+、effector memory CD8+ 和T helper type 1 (Th1) 细胞数量最低,而通常认为的与促肿瘤相关的Th2细胞数量则较高,提示肝转移组织处于免疫抑制状态。
作者发现胰腺癌肝转移组织中嘌呤能信号通路相关的基因表达失调,Veen图结果显示胰腺癌嘌呤能信号分子表达发生了显著的改变,其中ADORA2B位于上调基因的交集,而P2RX1位于下调基因的交集。ADORA2B属于P1嘌呤能信号受体,是经典的参与免疫抑制的嘌呤能受体, ADORA2B表达的上调与抗肿瘤免疫细胞浸润呈负相关;与之相反,P2RX1表达的下调与抗肿瘤免疫细胞浸润呈正相关,这提示P2RX1可能参与了抗肿瘤免疫反应。
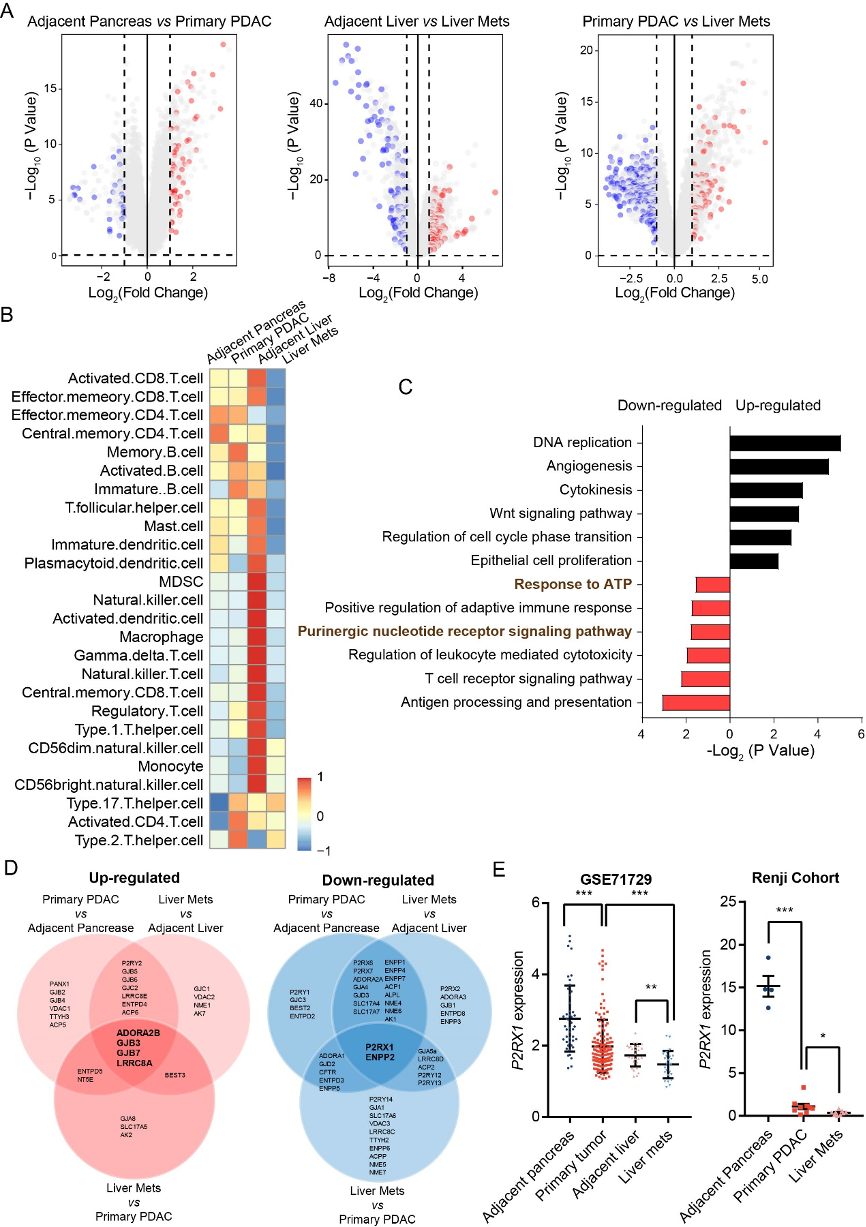
图1.P2RX1与临床胰腺癌肝转移中的免疫抑制微环境有关
为了进一步探讨P2RX1缺失促进胰腺癌肝转移的机制,作者对WT和P2rx1-/-小鼠正常肝组织day 0(D0)和day 3(D3)、day 17(D17)肝转移组织进行了RNA-seq。通过对结果进行分析,作者发现WT和P2rx1-/-小鼠免疫耗竭相关基因的表达,结果与临床转录组数据的结果一致,P2rx1-/-小鼠肝转移组织Pdcd1(PD-1)、Cd274(PD-L1)、Lag3等基因表达上调显著,这些结果表明,P2RX1表达缺失促进胰腺癌肝转移可能与免疫耗竭有关。
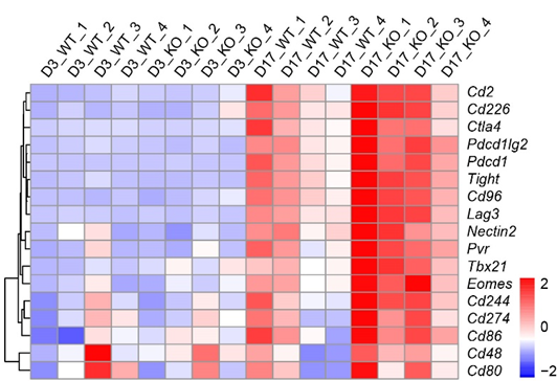
图2.WT和P2rx1-/-小鼠在D3和D17时肝转移中免疫检查点分子的热图分析比较
接下来,作者运用流式细胞术检测了肝转移小鼠模型中PD-1及其配体PD-L1、PD-L2和CTLA-4及其配体CD80、CD86免疫耗竭分子表达,结果显示,P2rx1-/-小鼠CD8+T细胞PD-1和CTLA-4表达升高,提示处于较高的免疫耗竭状态。与P2RX1+中性粒细胞相比,WT小鼠中的P2RX1-中性粒细胞和P2rx1-/-小鼠中的中性粒细胞表达较高的PD-L1和CD86,各组中性粒细胞均不表达PD-L2和CD80,与CD86相比,P2RX1-和P2rx1-/-中性粒细胞PD-L1的表达更强,因此流式的结果提示P2RX1表达缺失引起的PD-L1上调可能参与了胰腺癌肝转移免疫抑制微环境形成。
为了明确P2RX1-中性粒细胞对抗肿瘤免疫的抑制作用,作者在体外进行了共培养实验。OT1细胞为TCR转基因的CD8+T细胞,可特异性地识别卵清蛋白(OVA)来源的抗原肽SIINFEKL,将OVA慢病毒导入KPC细胞后制作可被OT1细胞识别并杀伤的胰腺癌细胞(KPC-OVA),体外共培养实验证实了活化的OT1细胞对KPC-OVA细胞具有明显的细胞毒作用,而对空载慢病毒导入的KPC细胞(KPC-LV)无明显的杀伤。
接下来,作者进一步研究了WT和P2RX1-中性粒细胞对OT1细胞杀伤KPC-OVA细胞的影响,体外共培养结果显示与WT中性粒细胞相比,P2RX1-中性粒细胞更加明显地抑制了OT1细胞的细胞毒作用,anti-PD-L1单抗的运用则部分恢复了OT1细胞的细胞毒作用。这些结果表明P2RX1-中性粒细胞表达的PD-L1可直接抑制胰腺癌的抗肿瘤免疫。
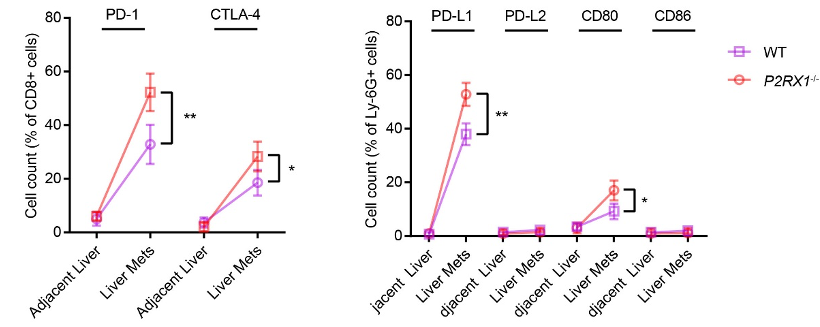
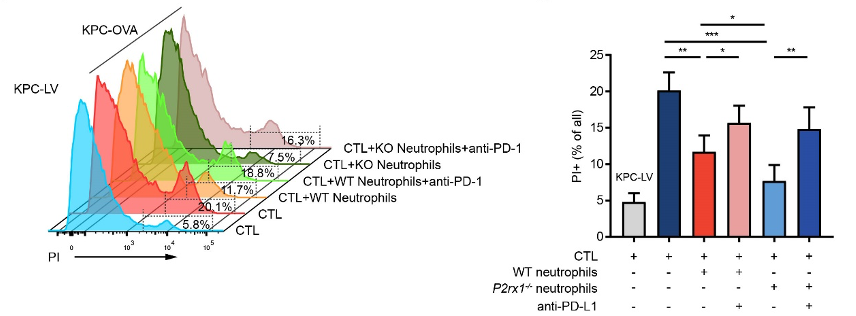
图3.P2RX1-中性粒细胞通过高表达PD-L1抑制胰腺癌抗肿瘤免疫

研究结论

1. 胰腺癌肝转移中嘌呤能信号受体P2RX1阴性(P2RX1-)中性粒细胞亚群浸润增多;
2. P2RX1-中性粒细胞通过表达PD-L1等免疫抑制分子介导胰腺肝转移免疫抑制微环境。

吉凯助力

本研究中用到的OVA过表达慢病毒为吉凯基因提供,用于感染KPC细胞,MOI 50。在体外共培养实验中过表达OVA抗原的小鼠胰腺癌KPC细胞可被活化的杀伤性CD8+OT1细胞识别,是研究肿瘤特异性杀伤性CD8+T细胞的重要工具。
惊喜福利

抓紧时间扫码报名吧 👇

作者简介
上海交通大学王旭、胡立鹏、秦魏婷、杨琴和江苏大学附属医院陈德玉为本文的共同第一作者,上海交通大学张志刚、张雪莉、蒋书恒和孙勇伟为本文的通讯作者。该研究得到了国家自然科学基金、上海市自然科学基金和上海市卫生计划委员会的资助。
张志刚,博士,研究员。2003年毕业于中科院遗传与发育生物学研究所,获博士学位。2003年至2009年在德国科隆大学医学院生化研究所博士后,2009年10月以人才引进方式来上海市肿瘤研究所癌基因及相关基因国家重点实验室工作,现任神经递质与肿瘤微环境研究组组长。中国生理学会基质生物学专业委员会主任委员,中国医师协会精准医疗委员会癌症代谢与治疗委员会副主任委员。已获得国家自然科学基金重大研究计划、国家自然科学基金面上项目、十二五国家重大专项、国家高技术研究发展计划(863计划)、上海市教委科研创新项目、上海交通大学“医工交叉研究基金”等课题资助。已发表SCI论文60多篇,以通讯作者在国际著名杂志Gastroenterology(2篇), Gut,Hepatology,Journal of Hepatology,Clincal Cancer Research,Cancer Research,Oncogene等发表多篇论文。上海市优秀学科带头人,上海市卫生系统优秀学科带头人,上海交通大学医学院“高原高峰”计划。申请国家发明专利9项,获国家专利授权6项,获国际PCT专利授权1项, 参与编写中英文专著2本。获上海医学科技二等奖(第一完成人)。Science子刊Metabolism Discovery杂志副主编。
点击【阅读原文】,立即参与报名。



 个人中心
个人中心
 我是园区
我是园区






