您还不是认证园区!
赶快前去认证园区吧!
 自20世纪60年代首次在动物模型中进行试验以来,抗体-药物结合物(Antibody-drug conjugates,ADC)经历了几次热潮。20世纪80年代开展了第一次ADC临床试验,首个ADC药物Mylotarg则于2000年首次获得批准。然而Mylotarg被撤市引起行业剧震,好在随后在2017年重新上市。
自20世纪60年代首次在动物模型中进行试验以来,抗体-药物结合物(Antibody-drug conjugates,ADC)经历了几次热潮。20世纪80年代开展了第一次ADC临床试验,首个ADC药物Mylotarg则于2000年首次获得批准。然而Mylotarg被撤市引起行业剧震,好在随后在2017年重新上市。
传统的基于小分子的ADC在三阴性乳腺癌等难以治疗的适应症中显示出有意义的优势;而新的药物设计模式也正在涌现,如新的有效载荷类别包括寡核苷酸、蛋白质和降解物等。ADC正在肿瘤学以外的新适应症中进行测试,新的linker和抗体工程技术正在使靶向元件和弹头具有巨大的多样性。该领域似乎正处于另一个指数增长阶段。
Drughunter汇总了FDA批准的ADC药物及其靶点和一些代表性弹头的结构(下图):

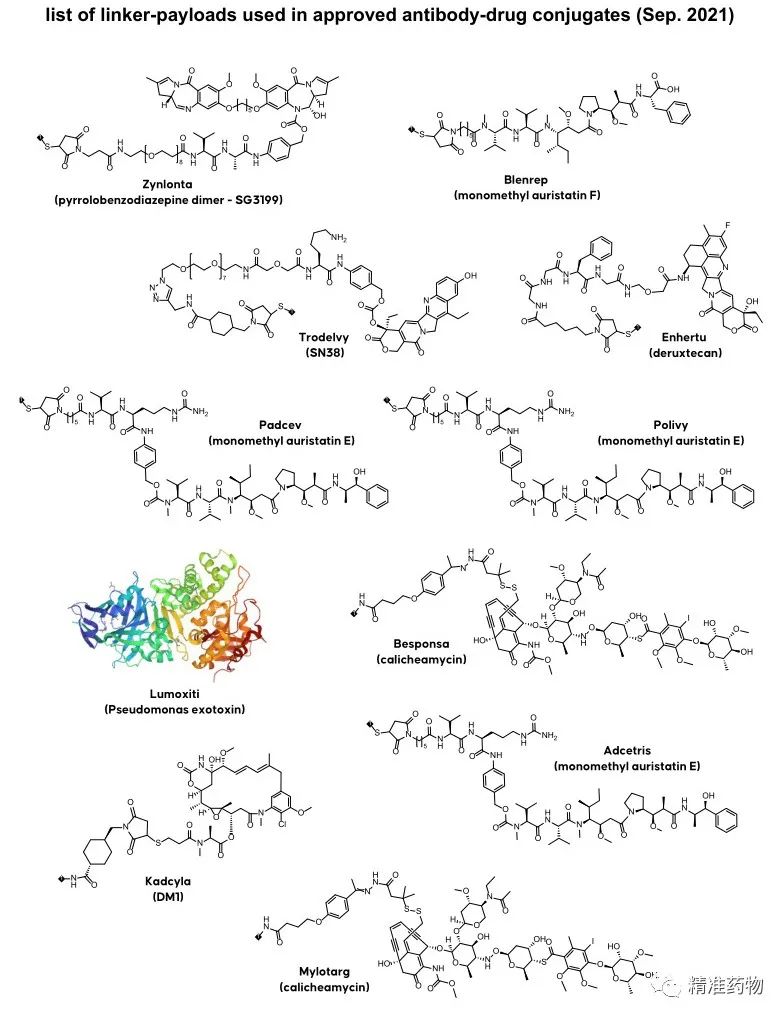
Drughunter另外一张图片汇总了FDA批准的ADC中使用的linker、有效载荷及弹头:
关注抗体圈公众号,回复关键字“2022”,
即可获取100个新靶点相关研究Excel表格下载方式
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




