▎药明康德内容团队编辑
2022年2月9日,Gamida Cell公司宣布,已启动向美国FDA滚动递交干细胞/骨髓移植产品omidubicel的生物制品许可申请(BLA)。Omidubicel作为一种潜在挽救生命的治疗药物,用于治疗需要干细胞移植的血癌患者。该公司有望在2022年第二季度完成BLA提交。

新闻稿指出,omidubicel有望成为美国FDA批准的首款用于同种异体干细胞移植的先进细胞治疗产品。对于有资格接受同种异体干细胞移植的恶性血癌患者,该手术是获得潜在治愈的最佳机会。不幸的是,每年依然有许多患者找不到合适的供体。与其他供体来源相比,omidubicel的匹配标准更为宽松,有潜力改善同种异体干细胞移植患者的结局,并使无法找到的合适供体患者获得治疗。
Omidubicel是一种用于治疗血癌患者的同种异体造血干细胞(骨髓)移植解决方案。利用小分子烟酰胺(NAM)的表观遗传学调控功能,在保留细胞特征和功能的同时,改善它们体外培养的扩增效果。新闻稿提到,omidubicel是首款获得美国FDA突破性疗法认定的干细胞移植产品,也已在美国和欧盟获得孤儿药资格。一项评估其疗效与安全性的
3期临床试验
达到了主要终点,证明与接受标准脐带血移植的对照组患者相比,omidubicel组患者中性粒细胞定植时间显著缩短,这是表明患者从干细胞移植中恢复的一个关键里程碑。该试验还达到了其次要终点,即降低了患者血小板定植时间、减少感染和缩短住院天数。
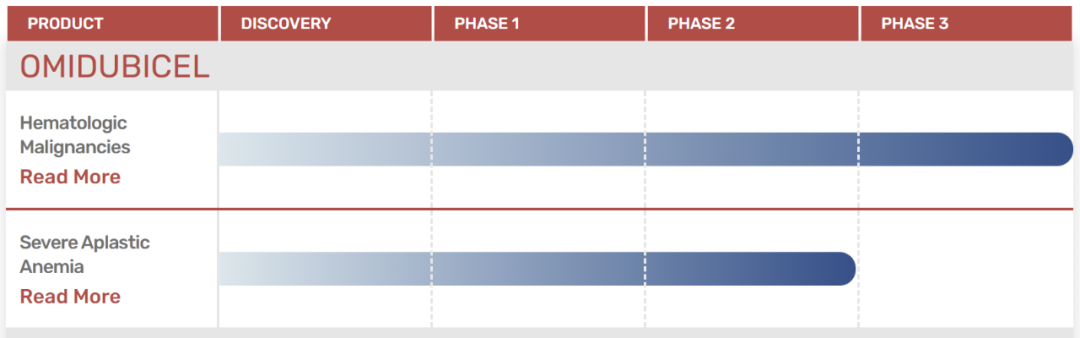
▲Omidubicel的研发进展(图片来源:Gamida Cell公司官网)
Gamida Cell首席执行官Julian Adams博士表示:“我们很高兴能达到omidubicel的这一重要里程碑,并使这一潜在疗法有望更快带给有需要的患者。在3期临床试验中,omidubicel证明了能够统计学显著性地减少中性粒细胞定植时间和住院时间、降低感染风险和缩短血小板定植时间。基于这些积极数据,我们认为omidubicel有望解决同种异体移植中现有的未满足需求,提供一种新的标准治疗,有机会治疗更多患者。”
参考资料:
[1] Gamida Cell Initiates Rolling Submission of Biologics License Application for Omidubicel. Retrieved February 9, 2022, from https://investors.gamida-cell.com/news-events/press-releases/news-release-details/gamida-cell-initiates-rolling-submission-biologics
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。








 个人中心
个人中心
 我是园区
我是园区




