在人类抗击传染病的斗争中,疫苗接种是最经济、最有效、拯救生命数量最多的卫生措施之一,特别是面对重大传染病疫情时,相应疫苗的研发进展更是被公众高度关注。
近年来,DNA重组技术、病毒样颗粒制备技术、反向疫苗学技术、多糖蛋白结合技术、疫苗投递技术等新技术的出现大大丰富了疫苗开发的技术线路,也大大加快了疫苗的开发速度。
疫苗的研发主要包括临床前研究和临床试验,上市前必须严格按照《药品临床试验管理规范》(GCP)开展Ⅰ期、Ⅱ期、Ⅲ临床试验,临床试验在疫苗开发周期中往往占据了很大的比例。
在提交IND申请时虽然已提交了比较完整的临床试验方案、研究者手册、日记卡、联系卡等临床试验用表卡,但这些仅仅是临床试验准备工作的一小部分,为了能在获得临床试验批件后快速启动临床试验,在提交IND申请还有很多工作要做。

需要根据临床试验批件的要求对临床试验方案进行完善,包括受试者年龄范围、临床研究终点、安全性评价指标、免疫原性评价指标、研究假设、受试者保护措施、质量保证和质量控制措施等。2020版GCP对于临床试验参与各方的全责进行了详细的规定,临床试验方案作为临床试验的灵魂,其内容建议描述尽量详细,并具可操作性,方案内容需符合2020版GCP第六章的要求。
I期临床试验着重于疫苗的常见、严重的不良反应,初步评价疫苗的免疫原性、最适剂量、排毒等特征,为扩大的II期临床试验提供试验设计依据。往往由于是新疫苗在人体上的首次试验,Ⅰ期临床试验通常首先在健康、免疫功能正常的成人中进行,若新疫苗目标接种对象为儿童/婴幼儿或老年人等其他特殊人群,通常应在健康成人进行试验之后,再逐步在小规模在老年人、儿童中进行,即进行Ⅰ期安全性评价时,应按先成人、后儿童、最后婴幼儿的顺序(通常每组各20-30人)分步进行。Ⅰ期临床试验一般无需设对照组和采用盲法,但为了评价需要也可采用安慰剂对照和盲法。安慰剂对照的引入可以有效地区分生理变化与疫苗的不良反应。
Ⅱ期临床试验常常采用随机对照盲法设计,主要评价疫苗在目标人群中安全性与免疫原性(通常是抗体动态规律),次要评价排毒与传播,确定疫苗使用最终剂量剂型。
Ⅲ期临床试验为疫苗有效性确证性试验,采用随机对照盲法设计,主要目的为评价疫苗在目标人群中的有效性和大样本人群中的安全性。对于有免疫替代终点的疫苗,可直接使用免疫原性数据评价保护性。对于没有免疫替代终点的疫苗,需要进行效力试验,评价疫苗在目标人群中的保护效力,并探索建立免疫学指标与效力的关联。
2020版GCP规定申办者的临床试验的质量管理体系应当涵盖临床试验的全过程并开展基于风险的质量管理。申办者作为临床试验数据质量和可靠性的最终责任人,需要建立包括临床试验的设计、实施、记录、评估、结果报告和文件归档在内各个环节的管理制度和操作管理程序。当将临床试验的部分或者全部工作和任务委托给CRO时,还需有CRO选择与管理的相关程序。
研究者手册是与开展临床试验相关的试验用药品的临床和非临床研究资料汇编,是指导研究者使用临床用疫苗的指南,帮助研究者判断药物不良事件或其它问题。研究者手册是申办者提供的一份非常重要的文件,当获得重要的新信息时,应当及时更新研究者手册。
按照2020版GCP要求,需申办方、临床研究机构、研究者共同签署临床研究合同。临床试验方案确定后,样本量及主要工作事项已可基本确定,可完善并签署三方的临床试验合同,明确各方职责,并注明申办者的监查和稽查、药品监督管理部门的检查可直接去到试验现场,查阅源数据、源文件和报告。
申办方应明确所需CRO提供的服务内容,是否包含临床试验监查、数据管理、统计分析服务等,根据服务内容拟定合同,按照2020年GCP要求明确各方权责。若临床试验监查工作委托给CRO,在进行CRO选择时需明确该公司是否与相应工作匹配的SOP及制度文件。与CRO的合同中需明确监查计划、监查报告等事项。
申办方完成临床试验用样品制备,并送中检院检定。在临床试验准备阶段可委托临床临床试验现场完成对照苗采购,将对照疫苗转运至申办方处,待统计方完成设盲程序后,完成临床试验用疫苗的编盲。
临床试验机构准备伦理审查所需材料,对于涉及生物样本采集的临床项目,在获得伦理批件后需向科技部人类遗传办提出采集申请。对于外资企业,申办方还需进行完成中国人类遗传资源国际合作科学研究审批。2021年4月15日开始实施的《中华人民共和国生物安全法》中对人类遗传资源的内容也有相应的规定。


在获得临床批件后申办方需要通过申请人之窗进入临床试验信息公示平台完成预登记,并参照临床试验方案内容在CDE临床试验信息公示平台上临床信息的填写临床试验相关公示信息并提交公示。按照《药物临床试验登记与信息公示管理规范(试行)》的要求,首次登记、提交及公示应在受试者招募前完成。往往申办方为了便于后续研究结果发表,除了在CDE临床试验信息公示平台上完成公示外,自行在中国临床试验注册中心或clinicaltrials.gov上进行临床试验信息公示。
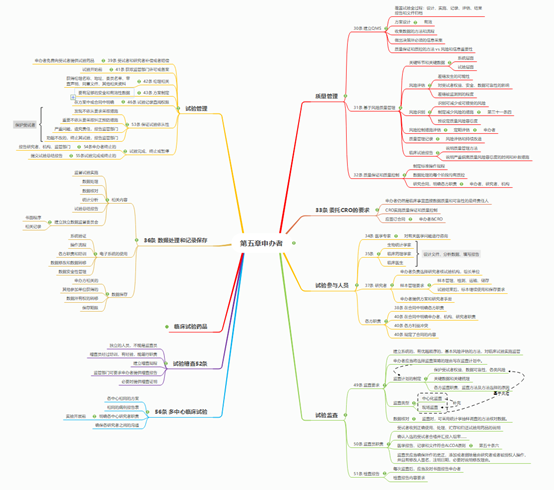
虽然新版《临床试验管理规范》未强制要求申办方设立独立的数据监查委员会(DSMB),但随着监管要求的提高,以及临床试验项目本身的需要, DSMB设立很有必要。DSMB负责定期对临床试验的进展、安全性数据和重要的有效性终点进行评估,并根据分析结果提出是否继续、调整或者停止试验的建议。另外Ⅲ期临床效力试验中需要成立EAC,对临床监测病例进行判定。新版《临床试验管理规范》中对于申办方的职责划分已非常详细,可参见下图:
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。








 药选址
药选址






