IPO早知道 | Finch Therapeutics:粪便移植微生物胶囊公司申请1亿美元IPO上市
收藏
关键词:
IPO微生物上市生物移植
资讯来源:蹊之美股生物医药 + 订阅账号
发布时间:
2021-03-04
微信公众号:蹊之美股生物医药 / CaesarBiotech
标的公司: Finch Therapeutics Group, Inc (NASDAQ: FNCH)
Finch Therapeutics提交了1亿美元募股书,该公司是一家临床阶段生物医药公司,专注于使用粪便移植的微生物组研发新型疗法。公司成立于2014年,在2017年与Crestovo Holdings LLC合并后成为Finch Therapeutics。
公司研发的新型疗法,旨在提供缺失的微生物及其临床相关的生化功能,以纠正营养不良和由此产生的疾病。

Finch Therapeutics
的产品管线由公司的Human-First平台驱动,使用反向翻译来识别营养不良的疾病,并设计针对这些疾病的微生物组疗法。目前公司进展最快的管线CP101口服微生物胶囊,已在2期临床中达到主要研究终点。
人类微生物群移植研究数据为该平台提供了动力。这些研究涉及了微生物群从健康个体到疾病个体的转移,涉及诸多领域的数百种研究和数十种不同情况。Finch Therapeutics利用这些研究数据,加上机器学习和分子表征技术,来确定微生物组破坏导致疾病的条件,并揭示与成功临床结果相关的关键动态。此外,使用人类微生物群移植研究进行的逆向翻译,避免了依赖于疾病的体外或动物模型而带来的翻译风险。
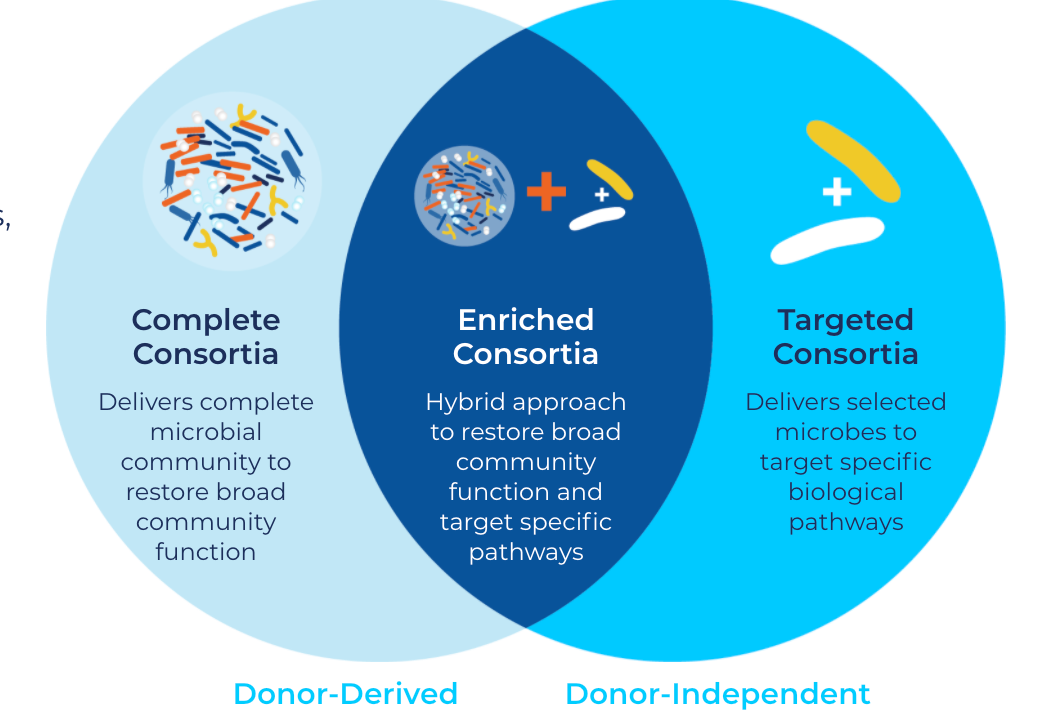
该平台使用机器学习算法来挖掘内部和第三方生成的临床数据,包括粪便微生物群移植(fecal microbiota transplantation,FMT)的经验,这是一种用于恢复肠道微生物组,解决community-level营养不良的手段。FMT通常需要进行结肠镜检查,但尚未获得美国FDA的批准,目前也没有测试、加工和递送FMT的标准。但FMT已被用于治疗超过50,000名患者,并正在进行数百项临床研究。
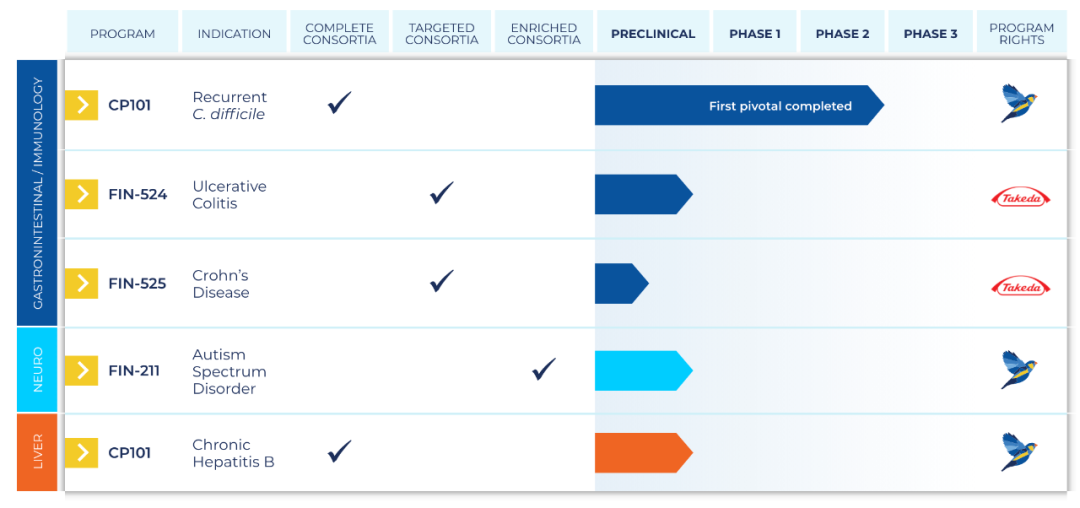
公司进展最快的管线CP101是一种口服的完整微生物组胶囊,旨在提供完整的功能性微生物组,以持久地修复community-level营养不良。CP101包含从严格筛选的健康人粪便样品中收获的微生物群落,这些样品已进行纯化、测试、稳定、表征,配制在耐酸胶囊中,以促进通过胃后的肠道释放。
重要的是,CP101中的病原体排除是通过与FDA讨论后开发的专有测试和表征技术,与正在开发的其他微生物组候选药物不同,它不依赖于非特异性杀生物剂,例如乙醇,会同时灭活有益细菌和潜在致病细菌。相反,Finch Therapeutics的技术使其能够在制造前确定合适的微生物群落,而无需对修复生物失调所需的健康群落进行破坏性干预。
这使CP101可以传递完整的微生物群落,而不是传递微生物组的狭窄且可变的子集。公司开发的专利化学和加工技术优化了产品的社区存活能力,在冻干、加工和管理过程中,创造了一个集成的制造过程来提供完整微生物组。
CP101的生产过程被设计为可规模化,只需小部分捐献者即可支持较大规模生产,公司相信200个捐献者每年可以支持10万份CP101的生产。此外,药物被设计为有良好的稳定性,在2°–8°C的条件下至少具有24个月的稳定性,在25°C的条件下具有超过6个月的稳定性,在给药过程中允许温度波动。
CP101在预防复发性艰难梭菌(Clostridioides difficile,CDI)感染或复发,已获得FDA的快速通道认定和突破性疗法认定。
在2020年6月,Finch Therapeutics宣布CP101治疗复发性CDI的临床2期关键研究PRISM3达到主要终点。该研究为随机、多中心、安慰剂对照研究,共入组206例患者,在使用标准治疗CDI抗生素后用CP101,对比单用CDI抗生素。
研究中,接受CP101单次给药的受试者,有74.5%达到了持续的临床治愈(定义为8周内没有CDI),达到了主要终点并具有统计学意义,与安慰剂相比,CDI复发风险降低了33.8%。
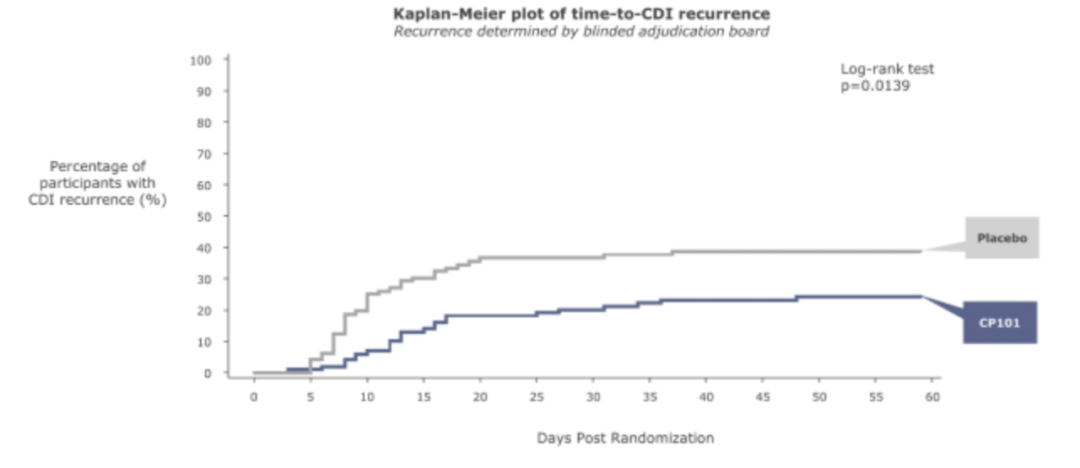
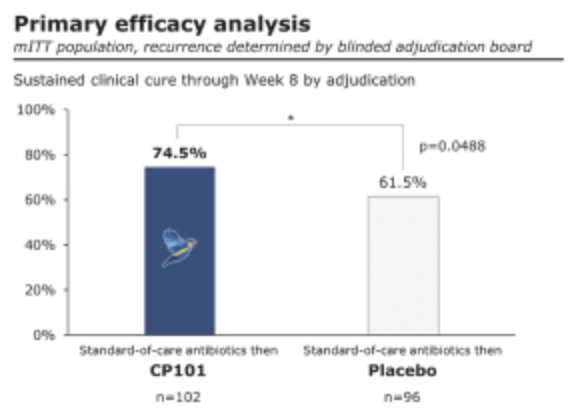
CP101和安慰剂组的不良事件发生率相似,CP101组中没有报告治疗相关的严重不良事件。公司计划在PRISM3的基础上,在2021年年中启动3期临床试验,作为CP101治疗复发性CDI的第2项关键临床试验。此外公司计划在2021年中,开展CP101治疗慢性HBV的临床试验。
费用$47M,现金$99M (As of December 31, 2020)
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com





 药选址
药选址



