【药研发0324】成都海创氘代AR拮抗剂报NDA | 高光制药TYK2/ JAK1抑制剂海外授权...
收藏
关键词:
药研发抑制剂制剂制药NDA药研发
资讯来源:药研发 + 订阅账号
发布时间:
2023-03-24
「 本文共:17条资讯,阅读时长约:3分钟 」
成都海创氘代AR拮抗剂报NDA。
海创药业自研第二代AR拮抗剂恩扎卢胺的氘代药物
德恩鲁胺
(HC-1119 软胶囊)新药上市申请获国家药监局受理,用于治疗转移性去势抵抗性
前列腺癌
(mCRPC)。在III期临床(HC-1119-04)中,与安慰剂相比,HC-1119治疗组患者的影像学无进展生存期(rPFS)的改善具有显著统计学意义,显著降低患者的疾病进展风险,此外,临床试验中未观察到癫痫事件。
1.神州细胞新冠疫苗获批紧急使用。
神州细胞自研重组
新冠
4价S三聚体蛋白疫苗
SCTV01E
获国家药监局批准纳入紧急使用。III期临床结果显示,针对BA.1和BA.5变异株,SCTV01E与辉瑞mRNA疫苗相比达到优效性标准,SCTV01E诱导的真病毒中和抗体滴度值较基线提高24.8倍(vs14.1倍),以及22.6倍(vs13.1倍)。2022年12月,神州细胞的2价S三聚体蛋白疫苗SCTV01C已被纳入紧急使用。
2.AZ新一代BTK抑制剂在华获批。阿斯利康BTK抑制剂阿可替尼胶囊(acalabrutinib,康可期)获国家药监局批准上市,用于治疗既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。这是阿斯利康血液学管线中的核心产品之一。在Ⅱ期ACE-LY-004研究中,随访时间为38.1个月时,研究者评估的总缓解率(ORR)到达81%;患者的中位无进展生存期(PFS)为22个月,中位总生存期(OS)达到59.2个月。
3.永泰CD19/TGF-β靶向CAR-T获批临床。
永泰生物1类生物药
迪诺仑赛注射液
(RC19D2)获国家药监局临床许可,拟开发用于治疗CD19阳性的复发难治弥漫性大B细胞
淋巴瘤
(DLBCL)患者。RC19D2是一款同时靶向CD19和TGF-β的CAR-T疗法,具备识别和杀伤表达CD19分子靶细胞能力并拮抗TGF-β信号的功能,可延长体内CAR-T细胞存活时间并促进CAR-T细胞浸润。该疗法有望为实体瘤患者提供持久的治疗效果。
4.默沙东PD-1单抗SC剂型在华获批临床。
默沙东1类生物制品
MK-3475A注射液
获国家药监局批准开展用于治疗
肺癌
的临床研究。MK-3475A由PD-1单抗帕博利珠单抗与透明质酸酶组成,为皮下注射(SC)剂型。目前,默沙东正在一项随机、开放标签Ⅲ期临床中,评估皮下注射MK-3475A与静脉注射帕博利珠单抗相比,一线治疗转移性非小细胞肺癌成人患者的药代动力学(PK)和安全性。
5.深圳茵冠干细胞疗法获批中风临床。
深圳茵冠生物“
人脐带间充质干细胞注射液
”1类生物制品获国家药监局临床许可,拟开发用于急性缺血性
脑卒中
(AIS)的治疗。该产品旨在通过旁分泌及免疫调节等多重机制,改善受损局部的微环境,抑制炎症反应、加速组织的修复、促进血管新生和神经再生等,有望为AIS患者的急性治疗提供新的选择。
6.高光制药TYK2/JAK1抑制剂海外授权。
高光制药与Biohaven公司达成合作许可协议,授权Biohaven在大中华区域以外独家开发TYK2/JAK1抑制剂
TLL-041
(BHV-8000),用于帕金森病、阿尔茨海默病、肌萎缩性侧索硬化症和多发性硬化症等
神经系统疾病
的治疗。根据协议,Biohaven将支付2000万美元首付款、9.5亿美元里程碑款及产品的销售分成。Biohaven计划将在2023年启动I期临床,双方在全球协作进行临床开发。
1.Incyte公司PD-1疗法获FDA加速批准。
Incyte公司开发的静脉注射PD-1抑制剂
Zynyz
(retifanlimab)获FDA加速批准上市,用于治疗转移性或复发局部晚期
默克尔细胞癌
(MCC)成人患者。在POD1UM-201试验中,Zynyz单药在此前未接受过化疗的患者中达到52%的客观缓解率(95% CI: 40-65);62%的患者DOR超过12个月。再鼎医药拥有这款新药在大中华区用于血液和实体肿瘤领域的独家开发权益。
2.再生元ANGPTL3单抗获批治疗儿童HoFH。
再生元靶向血管生成素样蛋白3(ANGPTL3)的单抗药物
Evkeeza
(evinacumab)获FDA批准扩展适应症,联合其他降脂药物用于辅助治疗5-11岁纯合子家族性
高胆固醇血症
(HoFH)儿童患者。在III期临床中,Evkeeza用于辅助治疗可使患儿的LDL-C水平较基线平均降低132mg/dL;有79%的患儿LDL-C至少降低一半。Evkeeza是首个ANGPTI-3靶向疗法,已获批用于辅助治疗12岁及以上HoFH患者。
3.安斯泰来Claudin 18.2单抗胃癌Ⅲ期试验成功。
安斯泰来CLDN18.2单抗
zolbetuximab
联合化疗一线治疗局部晚期不可切除或转移性
胃癌或胃食管结合部
(GEJ)
腺癌
的Ⅲ期临床GLOW达到主要终点和关键次要终点。与安慰剂联合CAPOX化疗相比,zolbetuximab与CAPOX联合治疗显著改善患者的无进展生存期(8.21个月vs6.80个月)和总生存期(中位OS:14.39个月vs12.16个月),药物安全性与之前结果一致。该公司计划向全球监管机构递交上市申请。
4.诺华SMA基因疗法长期疗效积极。
诺华基因疗法
Zolgensma
(OAV101)用于治疗
脊髓性肌萎缩症
(SMA)的两项试验(LT-001和LT-002)长期随访结果积极。LT-001是一项针对已完成Ⅰ期START试验的患者进行为期15年的长期随访研究,最新数据显示,在给药后7.5年,接受治疗的患儿维持原先拥有的所有运动能力里程碑(motor milestones),其中3例患者到达“辅助站立”的关键里程碑。在LT-002研究中期结果显示,100%患者维持从母研究期间所达到的运动能力里程碑。
5.89bio公司NASH新药Ⅱb期临床积极。
89bio公司成纤维细胞生长因子21(FGF21)类似物
pegozafermin
在用于治疗非酒精性
脂肪性肝炎
(NASH)的Ⅱb期临床达到组织学主要终点。与安慰剂相比,pegozafermin(每两周一次44mg和每周一次30mg)治疗显著提高达成至少一个阶段的纤维化改善且NASH症状没有恶化的患者比例(27%和26%,vs7%)。该新药此前已在治疗严重性高甘油三酯血症(SHTG)的Ⅱ期临床获得概念验证结果。
6.艾伯维帕金森复方被FDA拒绝批准。
艾伯维创新复方疗法
ABBV-951
用于治疗
帕金森病
(PD)的NDA申请收到FDA的完整回复函(CRL)。ABBV-951包含左旋多巴和卡比多巴的前体药物,它具有很高的水溶性,可通过一个连接到皮下的泵实现持续24小时皮下输注给药,从而稳定维持药物在体内的浓度。FDA要求艾伯维提供ABBV-951设备(泵)的额外信息,无需再额外做与该药相关的疗效和安全性试验。
1.颜宁受聘担任深圳湾实验室主任。
据深圳湾实验室微信公众号消息,日前,经深圳市委人才工作领导小组推荐、广东省科技领导小组同意,深圳湾实验室建设发展协调小组审定,聘任
颜宁
为深圳湾实验室主任。颜宁表示,她愿与实验室全体员工以及关心实验室发展的各界友人一起,群策群力,攻坚克难,为建设国际一流科研机构而奋斗。
2.江苏部署适龄女生HPV疫苗接种。
3月20日,江苏省卫健委、省教育厅、省妇联在南京市召开2023年全省适龄女生
人乳头瘤病毒
(HPV)
疫苗
免费接种工作启动会议。江苏省政府将此项工作纳入2023年保障和改善民生实事清单,HPV疫苗免费接种预计至少惠及该省24.67万名适龄女生。2022年,江苏省无锡、连云港、南京、扬州4市率先开展在校适龄女生HPV疫苗免费接种试点工作,有6.4万名适龄女生免费接种疫苗。
3.新发突发传染病预警系统将建升级版。
近日,国家重点研发计划“
新发突发传染病
多点触发预警体系及关键技术的研发和示范应用”项目启动暨实施方案论证会在湖北省武汉市召开。该项目由华中科技大学等10家国内科研单位共同申报,获批总经费2995万元,计划在3年内建立多场景和多维度监测、智能触发、联防联控、应急指挥一体化立体式预警系统。
4.福建泉州医务人员第二次补助5000元/人。
近日,福建泉州市财政局发布《泉州市全力做好新阶段疫情防控经费保障》,强调关爱医务人员,落实激励政策。全市财政共投入1.7亿元,按照
人均5000元
标准,向各级公立医疗卫生机构医务人员发放一次性补助。此前,福建就曾向全省各级公立医疗卫生机构医务人员,发放过一次补助
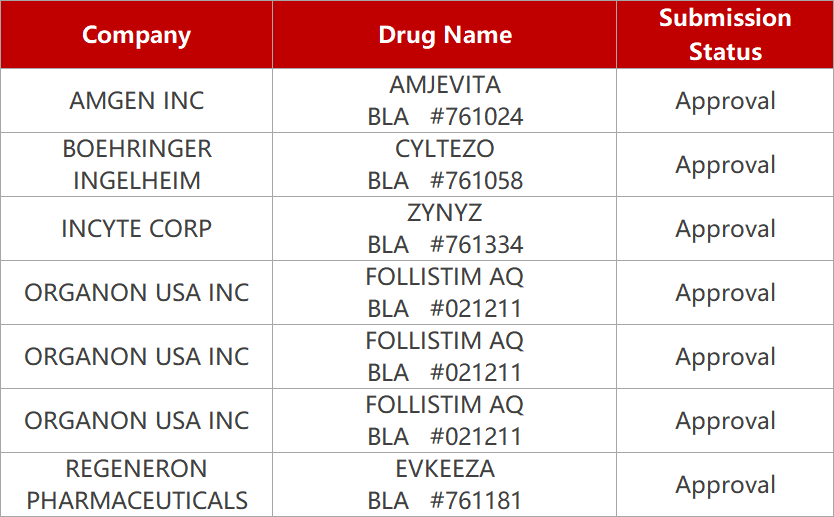
1. CDE新药受理情况(03月23日)
*ST 辅 仁
+5.17%
凯因科技
-5.12%
昂 利 康
+4.46%
ST 太 安
-5.08%
【恒瑞医药】公司收到国家药品监督管理局核准签发
关于海曲泊帕乙醇胺片的《药物临床试验批准通知书》,将于近期开展临床试验;公司的子公司成都盛迪医药有限公司收到国家药品监督管理局核准签发关
于HRS-5965的《药物临床试验批准通知书》,将于近期开展临床试验。
【步长制药】公司控股子公司浙江天元生物药业有限
公司的“四价流感病毒裂解疫苗(MDCK细胞)"临床试验申请获国家药品监督管理局的受理,并收到
《受理通知书》;公司的全资子公司通化谷红制药有限公司已完善盐酸法舒地尔注射液的申报资料,并收到国家药品监督管理局签发的关干药品注册的《受理通知书》。
【华海药业】公司收到美国食品药品监督管理局的通知,公司向美国FDA申报的布瑞哌唑片的新药简略申请(ANDA,即美国仿制药申请)已获得暂时批
- The End -

















 药选址
药选址














