
本周看点
本期(4月16日至4月25日),大批仿制药获批上市,多个单抗药物申报上市取得新进展,复宏汉霖新一代PD-1申报上市获受理,并拟纳入优先审批;诺和诺德一周一次长效糖尿病新药即将获批;曲妥珠单抗注射液迎来皮下注射剂。更多动态如下:
国内审评审批·新动态
本周CDE有214个受理号(118个品种)报生产办理状态更新,其中恒瑞医药卡瑞利珠单抗、诺和诺德司美鲁肽以及艾伯维阿达木单抗备受关注,更多动态如下:

数据来源:药智数据
恒瑞医药PD-1 鼻咽癌新适应症即将获批
恒瑞医药抗PD-1单抗卡瑞利珠单抗(艾瑞卡)新适应上市申请审批状态变更为“在审批”,或将于近日获批。该适应症为单药用于既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者。
卡瑞利珠单抗是恒瑞医药自主研发并具有知识产权的人源化PD-1单克隆抗体,于2019年5月获批上市,目前已成功获批霍奇金淋巴瘤、肝癌、非鳞非小肺癌、食管鳞癌四大适应症,并已全部被纳入2020年医保目录。
目前,在国产已获批上市的 PD-1 中,仅恒瑞和君实已经就鼻咽癌适应症报上市,包括鼻咽癌的三线治疗和一线治疗。君实生物特瑞普昔单抗已于今年 2 月获批三线治疗鼻咽癌。
糖尿病新药!诺和诺德一周一次长效GLP-1 类似物进入“在审批”
药智数据显示,诺和诺德 一周只需注射一次的长效GLP-1 类似物「司美鲁肽注射液」审评状态已变更为“在审批”,或将于近日获批。
司美鲁肽注射液(Semaglutide)是诺和诺德研发的一种长效胰高糖素样肽-1(GLP-1) 类似物,能起到GLP-1受体激动剂的作用 ,每周只须注射 1 次即可达到降糖效果。此前,该产品已经在美国被FDA批准用于成人2型糖尿病治疗,以及用于降低2型糖尿病和合并心血管疾病成人2型糖尿病患者的主要心血管不良事件风险。2019 年 9 月 20 日,诺和诺德索马鲁肽片剂获得美国 FDA 批准(规格:7 mg 和 14 mg),商品名为「Rybelsus」。该药是全球批准的首个口服 GLP-1 受体激动剂药物。
目前全球范围内已经批准上市每周注射 1 次的长效 GLP-1 抑制剂类药物有 5 款,分别是利拉鲁肽、度拉糖肽、索马鲁肽(注射+口服)、艾塞那肽微球。
目前国内已批准上市 6 款 GLP-1 受体激动剂,分别是进口有艾塞那肽(普通+长效)、利拉鲁肽、利司那肽、度拉糖肽;国产有贝那鲁肽、聚乙二醇洛塞那肽。司美鲁肽国内获批后,将成为国内第 7 款 GLP-1 受体激动剂。
“药王”修美乐获批儿童克罗恩病新适应症
近日,艾伯维全人源抗TNF-α单克隆抗体阿达木单抗注射液(修美乐)在中国获批新适应症,用于治疗对糖皮质激素或免疫调节剂(例如硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤)应答不足的6岁及以上的中重度活动性克罗恩病(ped CD)患儿。
据悉,这是目前中国唯一获批的可全程通过预填充式注射装置皮下注射治疗该疾病的全人源TNF-a单克隆抗体。这也是继类风湿关节炎、强直性脊柱炎、银屑病、多关节型幼年特发性关节炎、克罗恩病、非感染性葡萄膜炎等之后,修美乐在中国获批的第八个适应症,也是第三个儿童适应症。
修美乐是一款全人源抗肿瘤坏死因子α(TNF-α)抗体,也是全球首个获批上市的全人源TNF-α单克隆抗体。修美乐自2002年首次获批上市以来,已经先后获批治疗十几种不同的适应症,2020年修美乐实现超198亿美元销售额。
国内审评审批·新受理
本周CDE新增报生产受理号48个,共个31品种,其中复宏汉霖斯鲁利单抗、罗氏曲妥珠单抗和石药集团 度恩西布胶囊备受关注,更多动态见下表:

数据来源:药智数据
不限癌种!复宏汉霖斯鲁利单抗注射液申报上市
药智数据显示,复宏汉霖创新型PD-1抑制剂斯鲁利单抗注射液(HLX10)上市申请已获CDE受理,并拟纳入优先审评程序。适应症为:经标准治疗失败的、不可切除或转移性高度微卫星不稳定型(Microsatellite Instability-High, MSI-H)实体瘤。该适应症依据特定的MSI-H肿瘤标志物进行筛查,不以癌种进行区分。
目前复宏汉霖已开展斯鲁利单抗的2项单药及8项联合疗法临床试验,积极就化疗、自有VEGF、EGFR靶点单抗等治疗方案进行免疫联合疗法,全面覆盖了肺癌、食管癌、肝细胞癌、胃癌、头颈癌等高发大瘤种。此外,复宏汉霖与PT Kalbe Genexine Biologics(KG Bio)达成合作协议,授予其斯鲁利单抗首个单药疗法及两项联合疗法在东南亚地区10个国家的独家开发和商业化权利。
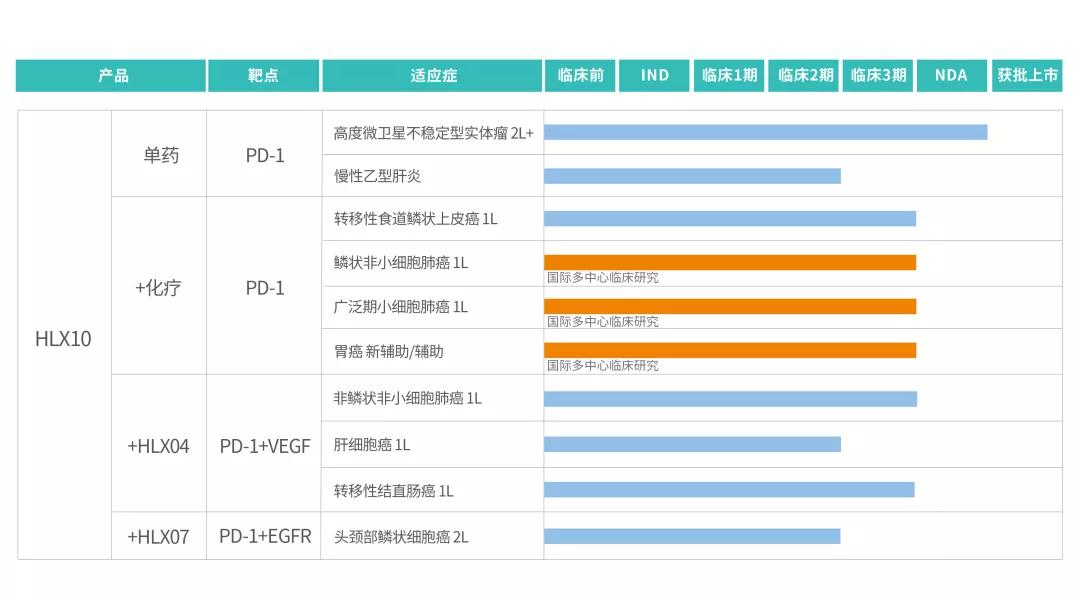
斯鲁利单抗临床研究进展(来源:复宏汉霖)
2017 年 5 月,美国FDA批准帕博利珠单抗用于 MSI-H/dMMR mCRC 的二线治疗。是首个免疫检查点抑制剂获批用于 MSI-H/dMMR 肿瘤的治疗。2020 年 6 月,美国FDA 又批准了帕博利珠单抗一线治疗 MSI-H/dMMR mCRC 患者的适应证。2018 年,FDA 加速批准了纳武利尤单抗 +伊匹木单抗联合方案用于 MSI-H/dMMR mCRC 的二线治疗。
目前,我国尚无针对MSI-H/dMMR晚期实体瘤获批的抗PD-1单抗。仅 2 家企业申报上市,包括康宁杰瑞/思路迪的 PD-L1 恩沃利单抗和复宏汉霖的 PD-1 斯鲁利单抗。
曲妥珠单抗注射液(皮下注射)在中国报产!
药智数据显示,罗氏的曲妥珠单抗注射液(皮下注射)上市申请获 CDE 受理。皮下注射的曲妥珠单抗是曲妥珠单抗(Trastuzumab)和重组人透明质酸酶(hyaluronidase)组成的复方制剂,2019 年 2 月获 FDA 批准用于治疗成人 HER2 过表达的转移性乳腺癌,商品名: Herceptin Hylecta®。
该药作为一种即用型制剂,在 2-5 分钟内即可完成给药,而静脉输注剂型赫赛汀则所需要的时间则是 30-90 分钟,极大缩短了给药过程的耗时。如能在国内上市,将会给医生和患者提供了一种新的选择。
石药 PI3K 抑制剂「度恩西布胶囊」上市申请获受理
近日,石药集团「度恩西布胶囊」上市申请获受理,并获得附条件批准及优先审评资格,用于治疗既往至少经过二线治疗/复发的滤泡性淋巴瘤(FL)的成年患者。
度恩西布是作用于 PI3K-δ和 PI3K-γ双靶点的抑制剂,2018 年 9 月获 FDA 批准上市,用于治疗既往至少经过二线治疗或者复发的滤泡性淋巴瘤的成年患者。石药集团以预付款 1500万 美元,及开发里程碑费至多 3000 万美元从 Verastem Oncology 公司引进了度恩西布。
 、企业公告等网络公开数据
、企业公告等网络公开数据
 、企业公告等网络公开信息
、企业公告等网络公开信息
责任编辑 | 琉 璃
排版设计 | 惜 姌
投稿爆料 | 18523380183(同微信)
转载授权 | 18523380183(同微信)
媒体合作 | 18323856316(同微信)
期待你的
分享
点赞
在看



 个人中心
个人中心
 我是园区
我是园区




