


王旭红
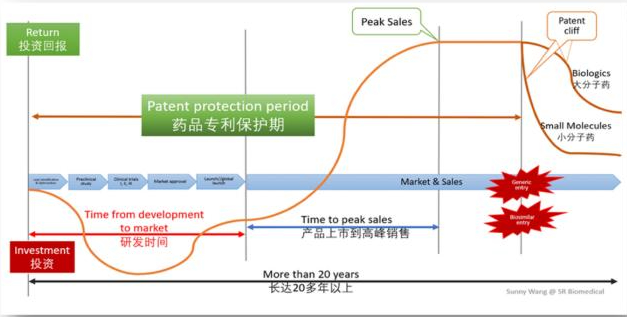

知道了“好钢用在刀刃上”的道理,那么对BD人员来说,BD中重要的IP考量,直接说,专利考量是什么?
这要看是“license-in(转入)”还是“license-out(转出)”。因为专利是地域性的,每个国家有自己的专利制度和法规,专利的价值和对专利的考量在不同的市场是不同的。
对“license-in(转入)”来说,产品是集中于中国市场,还是全球权益。如果是全球权益,则要看专利是否能够让全球的权益最大化。从专利的角度,主要关注的角度是:确权专利拥有人(patent owner);产品的专利是否足够强;外围的专利是否能增加保护力;还有自由实施的问题。
在BD合同中,需要确定谁是相关专利的控制人,谁支付专利费用,谁负责专利的相关诉讼,谁负责后续专利的申请等权利。一般来说,药品产品的持有人最好有其相关专利的控制权。但对中国年轻的生物公司来说,考虑要更实际些。比如美国或者欧洲的讼诉问题,如果对方更有经验,也愿意协助的话,也可以考虑对方负责诉讼。
某些中国公司从海外的制药大公司license-in产品。制药大公司一般申请产品专利时布局地域是非常广泛的,凡是有专利系统的国家和地区都可能包括。除了产品专利,再加上制剂,工艺,用途,联合用药等等专利家族,上千个专利保护一个新药产品并不是例外情形。
但对于中国初创公司,或者没有全球管理专利经验的公司来说,对专利的全球管理来说就是一大挑战。如果不能在签订协议前就了解清楚这些问题,就可能会给公司带来很大的困惑。
而对于“license-out(转出)”,是让中国研发的产品走到海外去。专注的方面则是:从研发开始就做好全球专利保护;用国际标准获得大市场的专利授权。
专利是一个先投入后收获的事业。如果没有前期的认真计划,仔细布局和全球战略,后期的收获可能会打折扣。
对BD来说,还有一个挑战就是尽职调查中的IP尽职调查。建议还是用专业的律所,有一个专业的尽职调查清单。即便是与跨国大公司做deal,也不要以为他们所有的事情都做的完美。
举个例子:一家跨国大药企将一产品权益转出给另外一家公司。该产品上市后不久,就有仿制药公司递交美国的Paragraph IV挑战其专利。受让公司在应对时才发现,专利拥有人并不是签署合同的主体,而是转让方的子公司。美国高院最后裁决受让方并没有专利拥有权,因此不能接受挑战。而这家跨国公司已经转让了此产品,也无法代表另外的公司接受Paragraph IV挑战,仿制药公司得以让仿制药上市。这是专利的问题,但归根到底是商务交易的问题。
从BD的角度上,理解IP在创新制药上的作用。在license-in的时候要确定产品的市场以及市场国家对专利的要求;在对外license-out时明确利用专利来增加其创新药的价值;从而在商务方面做出有利于企业的决定。所以,对于做创新药出海或者新药转入中国(尤其全球权益)的商务人员来说,学习一点专利的知识是很有用处的。
【第三届全球生物医药前沿技术大会】
相关报道文章推荐
● 写意报告丨脑卒中精准预防新药研发:全方位、全生命周期策略探索
● 写意报告丨全面考虑灵活与合规性,罗顺对GMP车间的改造胸有成竹
● 写意报告 | 赛道拥挤,唯创新者赢—全球研发全景对中国制药创新的启示
● 写意报告 | 罗楹:从TRK靶向蛋白降解剂开发看Protac设计
● 写意报告 | 从法律视角看医药核心人员的 “留用”与“引进”




 个人中心
个人中心
 我是园区
我是园区




