“如果说EGFR TKi是上天送给亚洲患病人群的礼物,那么CPI将会是中国生物医药拥抱世界的绝佳契机”
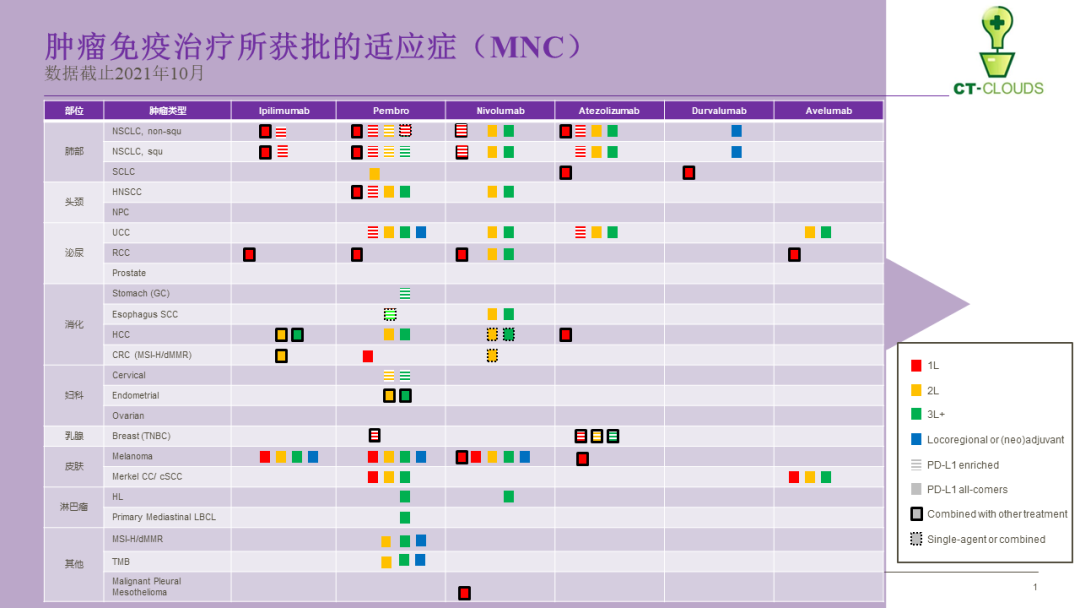
■ 自2011年3月CTLA-4在美国获批、全球首个PD-1于2014年7月7日被日本获批以来,过去十年,CPI已经在实体瘤和血液肿瘤领域获得20+适应症,在使用时机上涵盖早期的辅助治疗、一线、二线到末线治疗。
■ 中国作为全球CPI竞争最火的区域,超过10个CPI在不同/一致的适应症人群展开多维度竞争,在真实世界、海量产生的数据将会成为中国下一代CPI新药研发的绝佳资源。
■ 十年一回首,也许是我们再出发前需要复盘一下“Pro & Con”。

横向获批适应症比较后的差距
■ 从开发思路上,所有MNC在CPI的临床开发的适应症布局上,基本遵循受众人群的大小为核心,从晚线往前线推进的基本思维。
■ 在首个适应症获批后,由于成熟监管部门的持续跟进,后续适应症开发谨慎使用“有条件获批”路径以图后续商业化获利,而是基于对所开发适应症的理解,通过科学设计提高大适应症获批成功率。这点从PD-L1富集人群使用和多个被企业自动撤回的适应症可以管窥一二。
■ 监管部门的紧箍咒,不同企业持续押注扩大所获批适应症来修建护城河,因此在整个产品开发期间,基于所获取初步数据和评估投入产出率,All-in潜在的所有适应症,通过项目数量来转化成功数量。

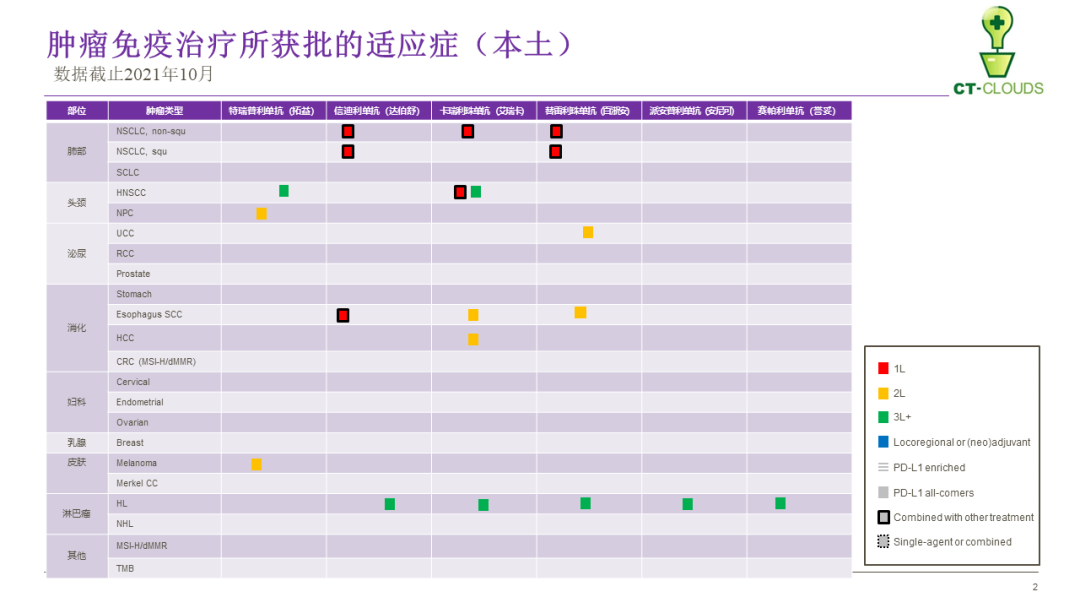
CPI开发的中国故事
■ 六个上市产品,五个都布局同一适应症人群“复发、难治性霍奇金淋巴瘤”,而且都申请“有条件批准”。
■ 除百济神州外,其余本土公司的临床开发仅仅局限于大陆本土人群,没能迈开步伐走向。
■ 临床开发思路,除了借鉴国外获批适应症,也同步布局中国特色的肿瘤,譬如鼻咽癌和食管鳞癌,这点正面证明本土研发的核心价值所在“满足国内临床亟需治疗”。

识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区
 参考资料:
参考资料:



