精彩内容
3月12日,NMPA发布药品获批信息,奥赛康的盐酸帕洛诺司琼注射液通过一致性评价,该产品2019年在中国公立医疗机构终端的销售额超过10亿元。好消息接踵而来,奥赛康的艾曲泊帕乙醇胺片4类仿制上市申请已进入“在审批”阶段,即将拿下国内首仿。
超10亿注射剂,已形成“原研+3仿制”格局
图1:奥赛康的盐酸帕洛诺司琼注射液获批情况

来源:NMPA官网
帕洛诺司琼是第二代选择性5-羟色胺受体拮抗剂,是临床指南中预防CINV(化疗所致恶心呕吐)三联用药中的一线用药,同时也是预防术后恶心呕吐一线用药。盐酸帕洛诺司琼注射液的原研企业是瑞士Helsinn Healthcare SA公司,2018年获批进入国内市场。
图2:2020H1盐酸帕洛诺司琼注射液的企业格局
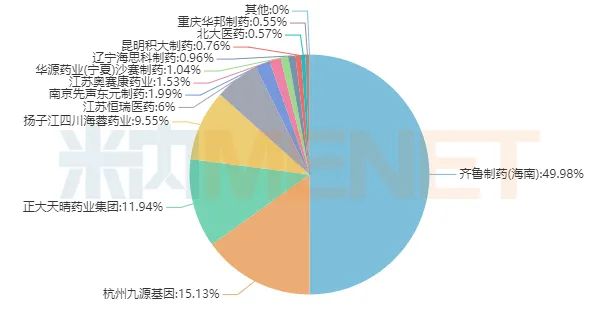
来源:米内网中国公立医疗机构终端竞争格局
米内网数据显示,2019年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端化学药止吐药和止恶心药产品TOP20中,盐酸帕洛诺司琼注射液排在榜首,销售额已超过10亿元,2020H1被甲磺酸多拉司琼注射液超前,退至TOP2。从企业格局来看,为国内药企主导市场。
今年2月7日,NMPA发布的公告中提到,齐鲁以及海思科的补充申请在同日过评,加上本次奥赛康的补充申请过评,盐酸帕洛诺司琼注射液已形成了“原研+3仿制”格局。
首家申报上市,将拿下诺华超$10亿品种首仿
图3:艾曲泊帕乙醇胺片仿制上市申请情况
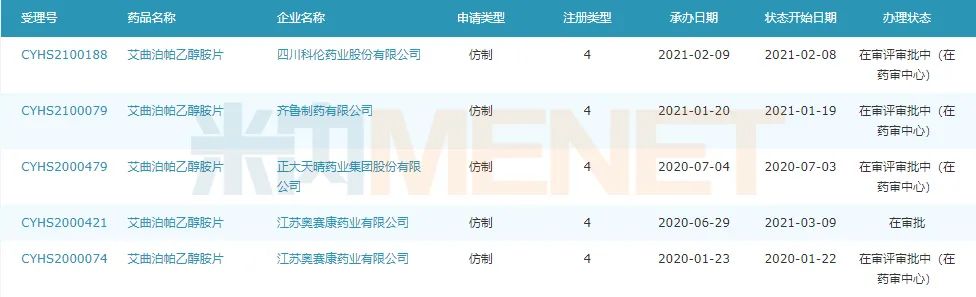
来源:米内网MED2.0中国药品审评数据库
艾曲泊帕乙醇胺片是诺华开发的一种非肽类血小板生成素受体(TPO-R)激动剂,用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性免疫性(特发性)血小板减少症(ITP),该产品2020年的全球销售额已超17亿美元。
原研产品2017年获批进入中国,2019年进入国家医保目录,随后在中国公立医疗机构终端开始高速放量,2019年销售额增速高达4756%,而2020H1的增速也超过1772%。
目前该产品已有4家国内药企申报4类仿制上市,奥赛康申报时间最早,其中受理号CYHS2000421已进入“在审批”阶段,正大天晴、齐鲁、科伦紧随其后。能在一众国内巨头之中突围拿下首仿,奥赛康的实力不容小觑。
数据来源:NMPA官网、米内网数据库
数据统计截至3月15日,如有疏漏,欢迎指正!
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092



 个人中心
个人中心
 我是园区
我是园区




