
点评 | 王盛典(中科院生物物理所)、朱明昭(中科院生物物理所)
cGAS-STING通路是机体对细胞质累积的DNA进行识别和反应的重要途径之一。多种病理条件下,包括肿瘤细胞的快速增殖和错配修复等均可产生胞质DNA。cGAS作为胞质核酸感应器,能够直接结合胞质DNA催化第二信使cGAMP的形成。后者可通过细胞膜转运蛋白或经细胞间隙到达肿瘤微环境。STING直接结合cGAMP,参与响应病原体或自身衍生的DNA,从而诱导保护性免疫。STING信号的级联放大,可激活多条炎症相关信号通路,包括NF-κB、细胞自噬和IRF3/I型干扰素
(IFN-I)
等,在肿瘤免疫中发挥重要作用。鉴于其促免疫激活、动员和分化的能力,新型STING 激动剂已被广泛开发研究应用于多种实体瘤的免疫治疗。临床前研究表明,先天免疫细胞STING 信号的活化可通过产生IFN-I等启动CD8+ T细胞抗原特异性的免疫应答,或者直接活化自然杀伤性NK细胞。STING 信号活化可以分泌大量干扰素诱导PDL1表达上调,临床肿瘤研究通常以免疫检查点抑制剂
(immune checkpoint blockade,
ICB
)
PD1/PDL1抗体与STING 激动剂联合使用。然而遗憾的是,STING 激动剂单药收效甚微,与ICB联用的有效率与ICB单药的响应率接近。迄今为止,尚未有成功的STING激动剂药物进入临床三期实验。肿瘤患者对STING激动剂免疫疗法产生抵抗的机制尚不清楚,亟需进一步阐明。
2022年10月5日,来自北卡罗来纳大学教堂山分校Lineberger综合癌症中心的Jenny P.Y. Ting 院士团队与Yuliya Pylayeva-Gupta实验室合作在Nature在线发表研究长文
STING-induced regulatory B cells compromise NK function in cancer immunity
,
首次揭示STING信号诱导调节性B细胞(Breg)抑制NK细胞抗肿瘤作用的新型免疫逃逸机制,为基于STING激动剂的联合治疗提供了全新思路
。
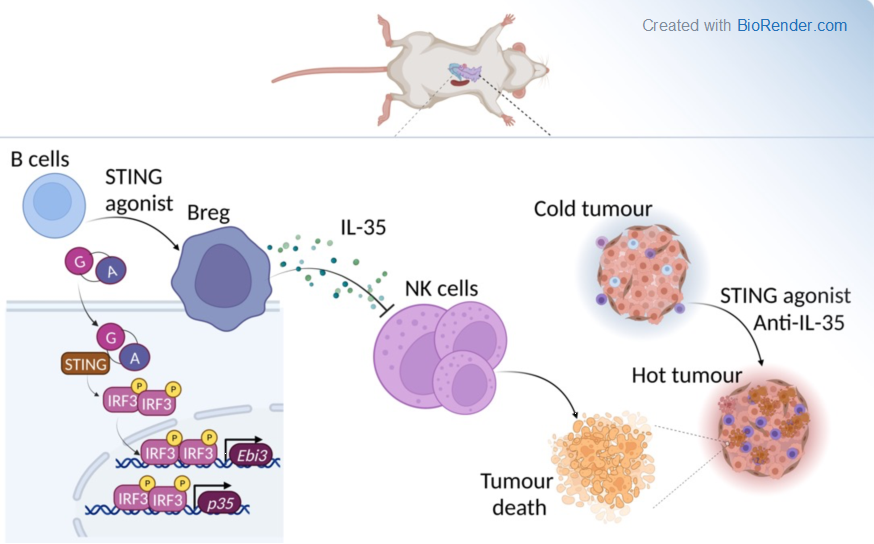
研究者首先建立实体瘤胰腺癌原位小鼠模型,尾静脉注射低剂量cGAMP,对肿瘤浸润的免疫细胞进行分析发现,
治疗组CD45+细胞中B细胞所占百分比以及B细胞绝对数量均显著增加。
进一步的过继回输实验则证明肿瘤局部增殖的B细胞主要来源于脾脏。利用B细胞特异性敲除STING的小鼠
(Cd19creTmem173fl/fl)
构建多种肿瘤模型,动物实验结果显示B细胞内在的STING信号激活可重塑肿瘤微环境进而促进肿瘤生长。RNA-seq数据显示,B细胞STING信号活化可诱导抑制性分子IL-35的功能亚基Ebi3和Il10等多种炎症反应基因
(inflammatory response genes)
表达上调。IL-35与IL-10普遍被认为具有免疫抑制功能。后续研究阐明STING信号诱导表达抑制性细胞因子的过程不依赖于IFN-I,而是依赖STING下游IRF3的转录活性。本研究发现瘤内IL-35和IL-10的蛋白含量与瘤重呈正相关,而与杀伤性免疫细胞的浸润程度呈负相关。进一步的体内实验证实,在B细胞中特异性敲除IL-35或利用IL-35阻断抗体分别与STING激动剂联合使用,在多种肿瘤模型中均可以发挥最大抗肿瘤效应。而阻断IL-10则没有观察到任何增益效应。尽管阻断IL-35可以显著提高STING激动剂治疗组肿瘤浸润的NK细胞和TNF
+
杀伤性CD8
+
T细胞的百分比和绝对数量,但后续的杀伤性细胞删除实验却证明,联合使用IL-35阻断抗体和STING激动剂的抗肿瘤效应主要依赖于NK细胞而非CD8
+
T细胞。RNA-seq分析肿瘤浸润NK细胞的结果进一步提示,联合用药相比于单药处理组可显著促进NK细胞增殖进而发挥抗肿瘤的效应。
对临床标本研究中,研究者发现STING激动剂对胰腺癌病人外周血B细胞具有类似的调控效应。随后研究者分离了外周血中的Breg亚群,在STING激动剂的刺激下,调节性B1
(Br1)
和未成熟B细胞
(immature B)
为主要产生IL-35的调节性B细胞亚群。The Cancer Genome Atlas
(TCGA)
数据库分析同样得到了支持性结论。在实体肺腺癌
(LUCD)
和胰腺癌(PAAD)临床队列中,STING/ISG 表征
(signature)
与Breg表征
(signature)
呈正相关而与活化的NK 表征
(signature)
呈负相关,以上这些临床相关的支持数据与本研究中动物实验部分的结论不谋而合。
综上,
本文根据肿瘤疗法STING激动剂在细胞和分子层面产生的效应循序渐进,证实了STING激动剂可诱导调节性B细胞
(Breg)
与NK效应细胞信号交互,负调控后者抗肿瘤的新型免疫逃逸机制。该工作拓宽了对STING通路效应的认识,为其联合用药控制实体瘤提供了全新思路,同时为NK细胞治疗方面提供借鉴价值。
本文的第一作者为北卡罗来纳大学教堂山分校Lineberger 综合癌症中心的李思睿博士和Bhalchandra Mirlekar博士。李思睿博士的研究方向主要为肿瘤免疫抑制分子的发掘和抗肿瘤免疫治疗,DNA sensing对免疫系统发生发展和功能的影响以及B细胞在生理和病理条件下的功能研究。
https://www.nature.com/articles/s41586-022-05254-3
王盛典
(
中科院生物物理所感染与免疫重点实验室
)
cGAS-STING
通路是机体免疫系统对胞质中异常
DNA
进行识别和反应的重要机制,最早是在抗病毒免疫中被发现和报道。
cGAS
识别并结合胞质中异常
DNA
,催化环鸟苷酸
-
腺苷酸
(cyclic GMP-AMP, cGAMP)
的形成。
cGAMP
作为第二信使结合并激活
STING
,从而激活下游的
IRF3
和
NF-kB
转录途径,诱导
I
型干扰素的表达和促进其它炎性细胞因子的产生,启动固有免疫应答。除了外源病毒或细菌
DNA
,细胞自身胞质
DNA
的异常沉积也会激活该通路,从而导致自身炎症和自身免疫疾病,同时研究也发现,
cGAS-STING
通路在机体抗肿瘤免疫中也发挥重要作用。大量临床前研究表明,激活先天免疫细胞的
cGAS-STING
通路能激发机体
I
型干扰素依赖的抗肿瘤
T
细胞免疫反应,新型
STING
激动剂被广泛开发,并应用于多种实体瘤的免疫治疗研究。但是,
STING
激动剂的临床肿瘤治疗效果不理想,甚至有研究发现,激活
STING
会促进肿瘤免疫逃逸和转移。
2022年10月5日,来自北卡罗来纳大学教堂山分校Lineberger 综合癌症中心的Jenny P.Y. Ting 团队与Yuliya Pylayeva-Gupta实验室合作在Nature在线发表题为STING-induced regulatory B cells compromise NK function in cancer immunity的研究论文,
首次揭示STING诱导肿瘤内调节性B细胞
(Breg)
产生,从而抑制NK细胞抗肿瘤作用的新型肿瘤免疫逃逸机制。
在该研究中,作者以冷肿瘤胰腺癌为小鼠肿瘤模型,多次静脉注射低剂量cGAMP进行治疗,肿瘤浸润免疫细胞分析发现,治疗特异性导致肿瘤内B细胞数显著提高。进而利用B细胞特异性STING敲除小鼠,证明B细胞内在STING信号促进肿瘤生长。RNAseq数据显示,B细胞STING信号活化可促进包括抑制性分子IL-35的亚基Ebi3和IL-10在内的干扰素反应和炎症反应基因表达。随后作者通过一系列试验证实,STING激动剂能诱导IL-35+Breg细胞的扩增,分泌免疫IL-35与IL-10,STING激动剂的这种诱导作用不依赖于IFN-I,而是依赖于下游转录因子IRF3的转录活性。尽管Treg也表达IL-10和IL-35,但是作者发现cGAMP并不增加表达IL-10或IL-35的T细胞。有意思的是,作者在B细胞特异性敲除或抗体阻断的多个小鼠肿瘤模型实验中发现,阻断IL-35与STING激动剂有协同抗肿瘤效应,而阻断IL-10没有协同效应;而且证明IL-35抗体和STING激动剂协同抗肿瘤效应依赖于NK细胞,而不依赖于T细胞。
该研究通过系列实验,证明B细胞STING的激活,能诱导肿瘤内Breg细胞扩增,分泌IL-35,抑制NK细胞的抗肿瘤作用,揭示了一种新的肿瘤免疫逃逸机制。同时,该研究也引出了诸多有意思的科学问题。例如:在STING激动剂的临床前抗肿瘤研究中,显示显著抗肿瘤作用的往往是瘤内注射,可以有效激活机体抗肿瘤免疫反应;而本研究采用静脉注射STING激动剂。cGAS-STING通路是机体有核细胞都具有的免疫识别反应机制,在不同的细胞和不同的环境中,其对细胞的调控作用不同。上海交通大学邓刘福团队就发现T细胞内的cGAS-STING信号(邓刘福团队揭示cGAS-STING介导的DNA识别通路),可通过维持CD8+T细胞的“记忆干性”促进T细胞抗肿瘤免疫应答。本文也观察到了T细胞敲除STING可促进肿瘤生长,但是同时在B细胞中敲除STING的小鼠中观察到相反的结果。这些研究均为STING激动剂的开发和应用提供了必要的理论参考。
朱明昭
(
中科院生物物理所感染与免疫重点实验室
)
STING信号通路一经发现,便迅速与肿瘤免疫发生了千丝万缕的联系:第一,STING信号通路在DNA病毒疫苗诱导杀伤性T细胞应答过程中发挥必要作用
【1】
;第二,STING信号通路下游的主要效应分子I型干扰素是促进抗肿瘤免疫应答的重要细胞因子
【2】
。第三,STING信号通路在放疗或体内自发诱导的抗肿瘤T细胞免疫应答过程中发挥关键作用
【3,4】
。第四,STING激动剂在小鼠体内诱导显著的抗肿瘤T细胞免疫应答
【5】
。一系列相关研究使得STING信号通路成为肿瘤免疫治疗领域高度关注的重要靶点之一。然而,STING激动剂的临床表现并不令人满意,迄今为止,还没有任何STING激动剂进入临床三期试验。是正作用不够还是负作用太强,是该领域亟待解决的关键科学问题。
美国北卡罗来纳大学教堂山分校Jenny P.Y. Ting 与Yuliya Pylayeva-Gupta团队的合作研究成果发现STING激动剂诱导肿瘤内IL-35+调节性B细胞
(Breg)
的大量产生,后者抑制了NK细胞的抗肿瘤功能。STING激动剂和IL-35阻断抗体联合使用,显著提高了肿瘤治疗效果。细读该文,多个研究结果令人印象深刻:
1.研究者首次发现STING激动剂在小鼠胰腺导管腺癌原位移植肿瘤模型中诱导免疫抑制性B细胞
(IL-35+Breg)
产生这一新现象,更新了人们对STING激动剂在肿瘤免疫中作用方式的理解。研究者还在多种小鼠肿瘤模型中验证了IL-35阻断和STING激动剂协同作用增强肿瘤治疗效果的新策略,为基于STING激动剂的联合治疗提供了新思路、新靶点。
2.研究者发现,在无外部干预条件下,B细胞中STING信号通路对肿瘤生长具有促进作用,并在多个小鼠移植肿瘤模型中(胰腺导管腺癌、三阴性乳腺癌、肺癌和黑色素瘤)进行了验证。这提示B细胞STING信号通路诱导Breg可能是机体自身编码并被肿瘤利用的一种较普遍的肿瘤免疫逃逸机制。
3.研究者发现,在小鼠胰腺导管腺癌肿瘤原位移植肿瘤模型中,Breg细胞表达的IL-35是STING激动剂治疗时免疫抑制的一个重要因素,因为B细胞缺失IL-35的Ebi3亚基,显著增强了cGAMP的肿瘤治疗效果。在该肿瘤模型的STING激动剂治疗中,Treg细胞表达的IL-35似乎不发挥肿瘤免疫抑制作用。
4.还有意思的是,研究者发现,胰腺导管腺癌患者的B细胞比健康人的B细胞,更容易被STING激动剂诱导表达IL-35的两个亚基Ebi3和p35,且主要来自未成熟B细胞亚群和Br1亚群。这提示肿瘤患者体内的B细胞状态或Breg前体亚群,相对于健康人,已经发生改变。
开拓性的研究当然也从来不缺乏引人深思之处。在未干预的荷瘤机体中,B细胞中的STING信号通路是如何被激活的?B细胞的肿瘤抗原特异性是否参与STING信号通路的激活和Breg的诱导扩增?在STING激动剂系统给药的条件下,Breg细胞是在哪里
(淋巴组织、肿瘤内)
诱导或扩增的?肿瘤三级淋巴组织中存在的B细胞是否可以被诱导成为Breg?肿瘤靶向STING激动剂给药是否可以避免Breg的诱导或扩增?STING-IRF3诱导的Breg与其它信号诱导的Breg在起源、功能等方面有何异同?这一系有趣的问题,值得进一步研究探索。
1.Ishikawa, H., Z. Ma, and G.N. Barber, STING regulates intracellular DNA-mediated, type I interferon-dependent innate immunity. Nature, 2009. 461(7265): p. 788-792.
2.Fuertes, M.B., et al., Type I interferon response and innate immune sensing of cancer. Trends Immunol, 2013. 34(2): p. 67-73.
3.Deng, L., et al., STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors. Immunity, 2014. 41(5): p. 843-52.
4.Woo, S.R., et al., STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity, 2014. 41(5): p. 830-42.
5.Corrales, L., et al., Direct Activation of STING in the Tumor Microenvironment Leads to Potent and Systemic Tumor Regression and Immunity. Cell Rep, 2015. 11(7): p. 1018-30.

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。









 个人中心
个人中心
 我是园区
我是园区





