
CRISPR-Cas系统(Clustered Regularly Interspaced Short Palindromic Repeats and CRISPR-associated)是一种在细菌和古细菌中发现的、由RNA介导的抵御外源核酸入侵的“获得性免疫系统”。目前发现的CRISPR-Cas系统主要分成两大类(Class1、Class2)。其中,Class 1可细分为3个类型 (type I,type III 和type IV),其共同特征是利用多亚基效应复合物和CRISPR RNA来实现对靶标序列的识别和切割过程。Class 2也细分为3个类型 (type II、type V、type VI),其共同特征是依赖于单一效应蛋白和CRISPR RNA来发挥功能。由于其作用机制相对简单,对其研究也比较透彻,Class 2中一些热门的效应蛋白,如Cas9、Cas12和Cas13已经被开发为高效的基因编辑工具和基因检测工具并已得到广泛使用。相反,Class I CRISPR系统并未受到广泛关注。其中,type I型是分布最为广泛的CRISPR-Cas系统,目前发现的CRISPR-Cas系统中约50%都属于该类。Type I CRISPR 使用Cascade(CRISPR-associated complex for antiviral defense)复合物来识别靶标序列DNA, 然后通过招募具有解旋酶和核酸酶功能的Cas3蛋白来切割靶标序列,从而引起靶标序列的大片段缺失来达到免疫效果。直至2019年,type I CRISPR系统才首次被报道用于人细胞基因编辑【1-3】,可在人细胞基因组中产生几百bp到100 kb不等的长片段基因删除。Type I CRISPR 中的Cas3蛋白可在基因组上远程位移并引起长片段缺失的特点在远程表观修饰、非编码DNA功能研究、以及大片段敲除致病基因等领域具有广泛的应用前景。因此,开发高效的、精简型的type I CRISPR系统将极大促进该类系统在上述领域的应用。
2022年1月19日,密歇根大学安娜堡分校张燕教授/侯仲刚博士研究组在 Molecular Cell 发表了题为Cas11 enables genome engineering in human cells with compact CRISPR Cas3 system的最新研究成果。该研究团队在基于type I型CRISPR系统的长片段基因编辑工具开发中取得重要进展,首次发现内部翻译产物Cas11小蛋白为实现多种type I CRISPR系统在真核细胞中获得高效基因编辑的关键因素。

在本项研究中,研究人员首先介绍了一种新型长片段基因删除工具,来源于Neisseria lactamica(Nla)的一种精简型(type I-C型)CRISPR-Cas系统,效应复合体由Cas8、Cas7、Cas5和CRISPR RNA组成,是目前所发现的最小的type I CRISPR系统。通过将纯化的Nla I-C系统的效应蛋白复合体和Cas3蛋白通过电转直接递送至细胞中,该研究组在人胚胎干细胞中获得了高达50% 的基因编辑效率, 在HAP1细胞中更是获得了高达95%的基因编辑效率。这是目前发现的最高效的CRISPR-Cas3型基因编辑器,远超先前报道的I-E型CRISPR-Cas3系统。通过长片段PCR分析,研究人员发现基因编辑导致了细胞内染色体靶标位点大量长度不同的基因片段缺失(几百bp到20kb不等),这些缺失都从靶向位点PAM序列的上游区域附近开始,而终止点分布在靶点PAM位点上游很广泛的区域,证明了该型CRISPR-Cas3基因编辑器有着优秀的造成长片段缺失的能力。
由于DNA和mRNA递送的便捷性和灵活性,该研究团队尝试了用质粒或mRNA递送Cas基因以达到高效的基因编辑,然而结果却不令人满意。令人意外的是,该研究发现Cas8蛋白C末端存在内部翻译机制,内部翻译产生的蛋白-Cas11在Nla I-C系统效应复合物的整合中起重要作用。由于真核生物(人细胞)无法识别原核系统的核糖体结合位点,Cas11在真核系统中无法翻译,导致了使用这一系统基于质粒和mRNA递送的基因编辑失败。基于此发现,研究人员在质粒递送和mRNA递送体系中加入了编码Cas11的质粒或mRNA后,成功使该系统在人细胞里产生高效基因编辑功能(图1)。
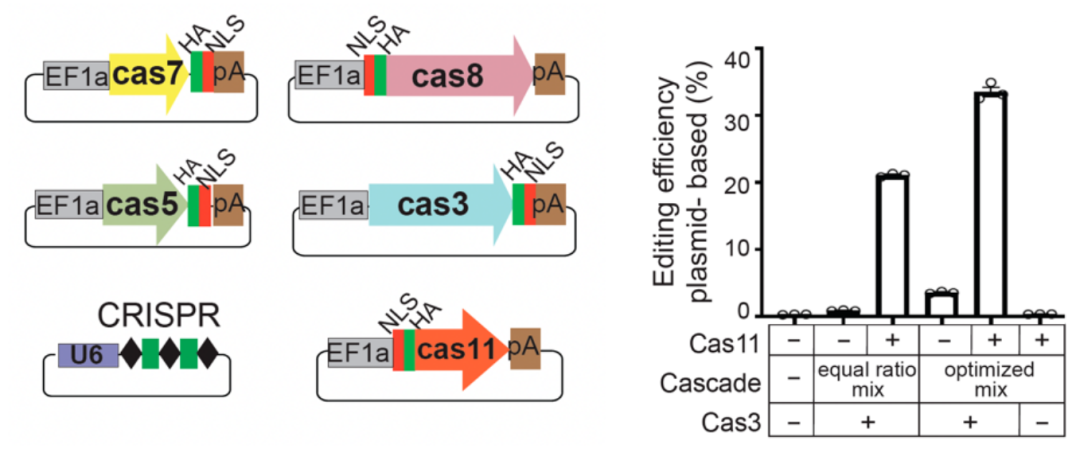
图1. Cas11是Nla CRISPR-Cas3系统在人细胞中获得高效基因编辑的关键
最后,该研究发现Cas11的内部翻译机制在多种type I CRISPR系统中(如 I-B, I-C和I-D)是保守存在的。在质粒递送体系中加入编码Cas11的质粒后,这些系统均可在人细胞中产生高效基因编辑,为type I CRISPR的应用提供了更多的选择 (图2)。
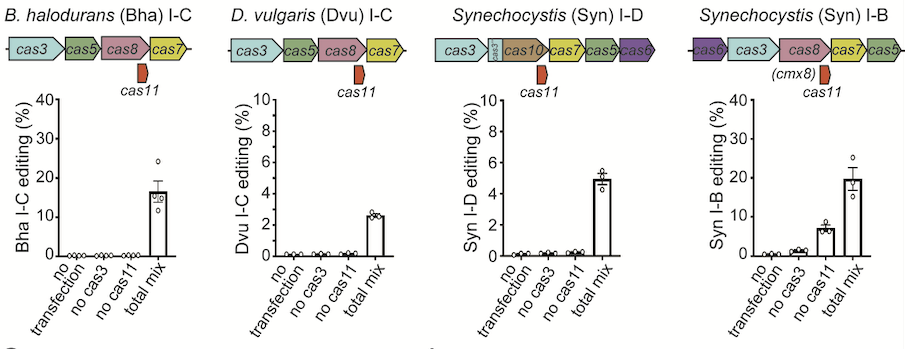
图2. 在质粒递送体系中加入Cas11可使多种type I CRISPR系统在人细胞中实现高效基因编辑
在人类基因组中超过98%的序列都属于非编码序列,不仅可以在多个层面上(表观遗传调控、转录调控以及转录后调控等)调控基因的表达,还与细胞生长分化以及疾病发生有着密切的关系。目前绝大多数的长链非编码区域的功能还是未知的,且用于筛选长链非编码序列的工具仍然有限。而通过改造type I型CRISPR-Cas系统,依赖crRNA和Cas3,可以在细胞基因组内构建大片段缺失文库,从而快速地筛选基因组内具有调控功能的长链非编码序列。开发基于CRISPR-Cas3系统的基因编辑器,可以极大地丰富基因敲除及基因检测的研究手段。
相比此前报道的type I-E CRISPR-Cas3系统,该研究报道的Nla-I-C型基因编辑工具效率更高,所需基因更少,为实现长片段基因删除提供了更加优越的解决方案。此外,Cas11蛋白保守的内源翻译机制的发现打破了type I CRISPR系统鲜有在真核系统中应用的局面,为更多type I 型基因编辑工具的开发奠定了基础。
据悉,密歇根大学助理教授张燕博士、研究员侯仲刚博士为该论文的共同通讯作者,课题组博士生谭仁可、硕士生Ryan Krueger为该论文的共同第一作者。康奈尔大学教授可爱龙博士和中国药科大学教授肖易倍博士对此项工作提供了重要的支持。
参考文献
1. A. E. Dolan et al., Introducing a Spectrum of Long-Range Genomic Deletions in Human Embryonic Stem Cells Using Type I CRISPR-Cas. Mol Cell 74, 936-950 e935 (2019).
2. P. Cameron et al., Harnessing type I CRISPR-Cas systems for genome engineering in human cells. Nat Biotechnol 37, 1471-1477 (2019).
3. H. Morisaka et al., CRISPR-Cas3 induces broad and unidirectional genome editing in human cells. Nat Commun 10, 5302 (2019).
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




