▎药明康德内容团队报道
6月25日,微芯生物发布公告称,日本医药品医疗器械综合机构(PMDA)已批准西达本胺(商品名:Hiyasta,海外编号:HBI-8000)上市,作为单一疗法治疗复发性或难治性成人T细胞白血病(ATL)。此前,沪亚生物(HUYA Bioscience International)已获得了西达本胺在美国、日本、欧盟等国家或地区的独家授权。

西达本胺是微芯生物开发的一款亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂。HDAC控制着细胞的存活、增殖、血管生成、炎症和免疫,在细胞信号传导中起着重要作用。由于HADC在基因表达中的基本作用以及对组蛋白和非组蛋白的不同影响,它已成为治疗多种恶性肿瘤的理想靶点。
根据微芯生物官网资料,西达本胺为全球首个亚型选择性HDAC口服抑制剂,主要针对第I类HDAC中的1、2、3亚型和第IIb类的10亚型,属于机制新颖的表观遗传调控剂类药物。在中国,西达本胺已先后获批用于治疗外周T细胞淋巴瘤、乳腺癌适应症。
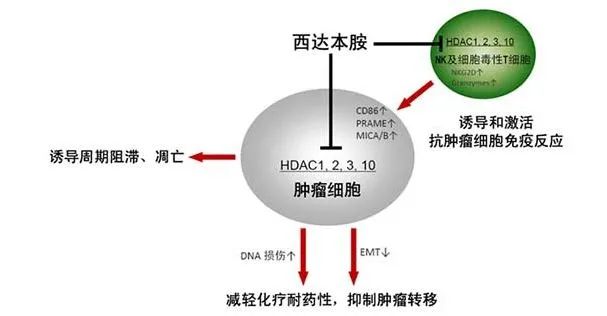
▲
西达本胺抗肿瘤分子作用机制(截图来源:参考资料[3])
2006年,微芯生物将西达本胺在美国、日本、欧盟等国家的权利授权给了沪亚生物
,由其共同推进西达本胺在多种适应症领域的全球同步开发与商业化。2020年10月,沪亚生物在日本提交了西达本胺的上市申请。该药本次获批的适应症为:作为单一疗法治疗复发性或难治性成人T细胞白血病,这也是西达本胺在中国境外获批的首个适应症。
根据公告,成人T细胞白血病是由人T细胞白血病病毒1型或HTLV-1潜伏感染引起的,它主要是一种预后不良的老年人疾病,化疗后三年内侵袭性成人T细胞白血病患者的生存率为25%,除了同种异体骨髓移植和高剂量化疗外,在符合条件的患者中很少有有效的治疗方案。
期待西达本胺早日来到更多患者身边,为他们提供新的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]
深圳微芯生物科技股份有限公司自愿披露关于公司产品西达本胺在日本获批上市的公告. Retrieved June 25,2021, from http://www.cninfo.com.cn/new/disclosure/detail?stockCode=688321&announcementId=1210328523&orgId=9900038965&announcementTime=2021-06-25
[2]西达本胺在日本递交首个适应症新药上市申请并获受理 . Retrieved Oct 13,2021, from https://www.chipscreen.com/show-784.html
[3]微芯生物官网. From https://www.chipscreen.com/pro_view-2.html
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。




 药选址
药选址

