 2022年3月的第一天,大洋彼岸终于传来好消息,FDA正式批准传奇生物/强生的BCMA CAR-T疗法西达基奥伦塞(Ciltacabtagene autoleucel)上市,用于治疗复发性/难治性多发性骨髓瘤,商品名为Carvykti。作为第2款BCMA CAR-T,Carvykti的定价为46.5万美元。百时美施贵宝的BCMA CAR-T定价为41.95万美元。今日成为首款出海的细胞疗法,值得庆贺!尤其是信达PD—1“闯关”FDA事件之后,更是为国内药企实现全球化创新带来了动力。
2022年3月的第一天,大洋彼岸终于传来好消息,FDA正式批准传奇生物/强生的BCMA CAR-T疗法西达基奥伦塞(Ciltacabtagene autoleucel)上市,用于治疗复发性/难治性多发性骨髓瘤,商品名为Carvykti。作为第2款BCMA CAR-T,Carvykti的定价为46.5万美元。百时美施贵宝的BCMA CAR-T定价为41.95万美元。今日成为首款出海的细胞疗法,值得庆贺!尤其是信达PD—1“闯关”FDA事件之后,更是为国内药企实现全球化创新带来了动力。

这不仅扫去了2.11之后中国出海药企的阴霾,打了一个漂亮的“翻身仗”,更是意味着中国在“细胞疗法”这个领域,正式走到了世界一线的位置:
这是首款获美国FDA批准的,由中国药企设计和研发的CAR-T疗法;
这是第二款由中国企业领导研发,获FDA批准的抗癌新药,距离上一款(百济神州泽布替尼)已经过去了两年多;
这是第二款获批上市的靶向BCMA的CAR-T疗法,也是中国第一款上市的靶向BCMA的CAR-T疗法;
受此消息影响,传奇生物股价盘后大涨12%,市值达到68亿美元。

传奇生物西达基奥仑赛FDA递交上市的申请基础为全球多中心临床试验数据,涉及美国、日本、欧盟等地区的临床研究数据,并且传奇生物主要终点设置为ORR,与已获批的Abecma设置标准对应,再者,美国市场仅一款同类型产品上市,且西达基奥仑赛面临的竞争较小。

Ciltacabtagene autoleucel采取了独特的二价纳米抗体设计,临床表现优异,平均12.4个月随访期,总缓解率ORR高达97%,sCR高达67%,12个月无进展生存率为77%,12个月总生存率为89%。

随访2年治疗获益进一步增加,ORR高达97.9%,sCR高达82.5%。

安全性方面,Ciltacabtagene autoleucel耐受性较好,3/4级CRS和神经毒性的发生率较低。

CARTITUDE-1继续进行中,入组美国患者和日本患者。Ciltacabtagene autoleucel还有其他多项临床研究在进行中。

传奇生物发展过程中的里程碑

来源:传奇生物公告、中康产业资本研究中心
美国研究显示cilta-cel长期疗效优异

来源:传奇生物公告、中康产业资本研究中心
国内外上市的CAR—T细胞疗法布局情况
自2017年美国FDA先后批准上市诺华和Kite的CAR-T疗法之后,全球现已批准上市了6款CAR-T疗法产品。其适应症均为血液肿瘤,涉及淋巴细胞白血病和骨髓瘤等,并未涉及实体瘤,而靶点涉及CD19和BCMA。
诺华的Kymriah作为FDA批准的首款CAR-T细胞疗法,目前在30个国家获批一项或多项适应症,在全球拥有超过350个经认证的治疗中心。随着覆盖范围的扩大,Kymriah 2021年销售额达到5.87亿美元,同比增长24%。去年10月,Kymriah第3项适应症上市申请获美国FDA和欧盟EMA受理,用于既往接受二线治疗后复发或难治性(r/r)滤泡性淋巴瘤(FL)成年患者。而在滤泡性淋巴瘤领域,Kite Pharma的CAR—T细胞疗法已基于ZUMA-5研究91%的ORR,60%的CR于去年3月获FDA批准。
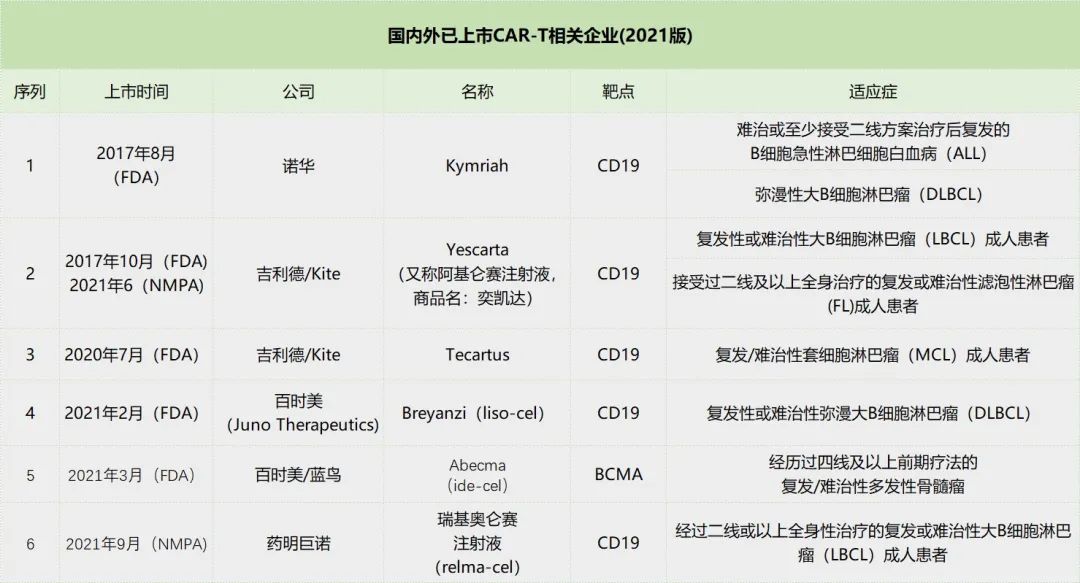
另一方面,国内已有两款CAR—T疗法上市。2021年6月22日,Yescarta(又称阿基仑赛注射液,商品名:奕凯达)正式获得批准,成为国内首款上市的CAR—T细胞疗法,其适应症为:用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。
2021年9月,药明巨诺申报的1类新药,靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)在国内获批上市,用于治疗经过二线或以上全身性治疗的复发或难治性大B细胞淋巴瘤(LBCL)成人患者。2022年2月27日,药明巨诺宣布其靶向 CD19 的自体嵌合抗原受体 T(CAR-T)细胞免疫治疗产品倍诺达®(瑞基奥仑赛注射液)用于治疗复发或难治性(r/r)滤泡淋巴瘤(FL)患者的新适应症上市许可申请已获 CDE 受理。这是药明巨诺针对倍诺达®递交的第二项上市许可申请。
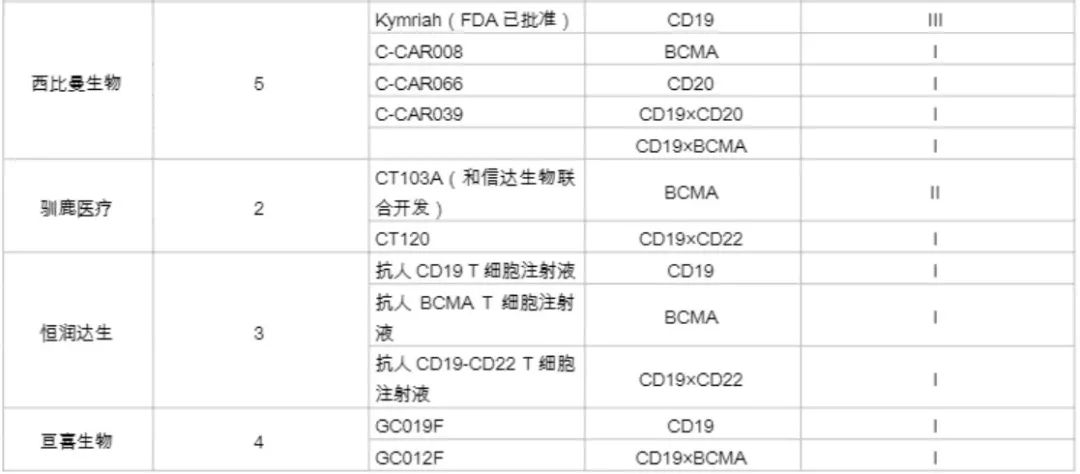
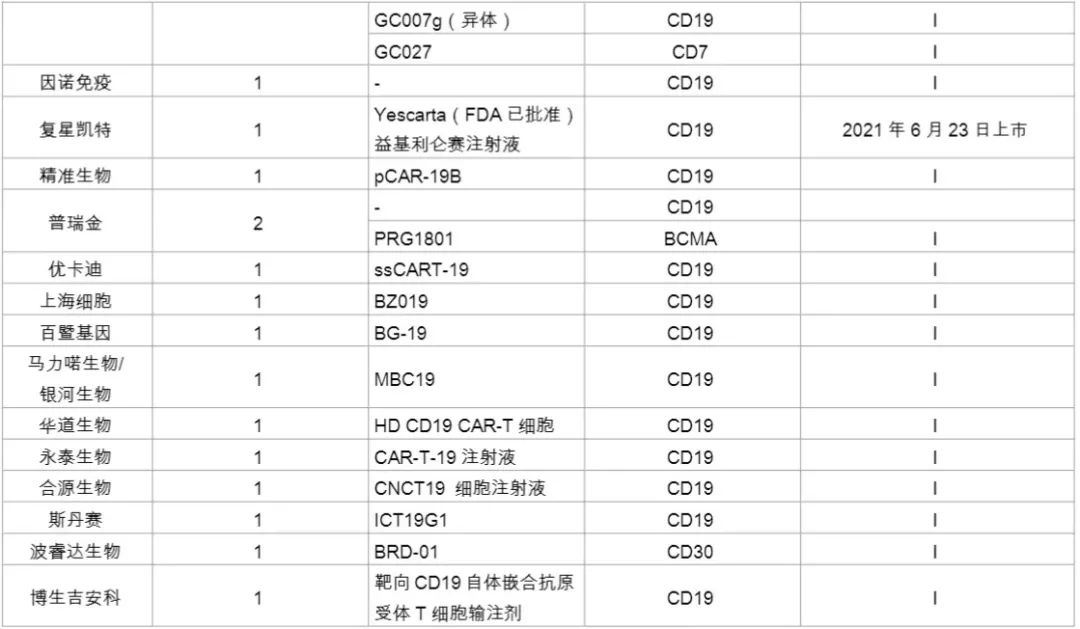
国内企业在针对实体瘤的开发上领先于外企,如科济药业在全球Claudin18.2靶向CAR-T疗法开发上居领先地位。其研发的首个靶向Claudin18.2的CAR-T疗法(CT-041),在美国获批临床,目前正在开展针对晚期胃癌的临床研究。同时,该疗法在EMA、加拿大的临床研究也获得了进展。此外,南京凯地生物和南京传奇生物布局开发了靶向Claudin18.2的CAR-T疗法,目前均处于临床I期。以下是本土企业对CRT细胞疗法的开发情况(详见下图)。
传奇生物在CAR—T细胞疗法的开发上获得认可与阶段性胜利,这增强了国内其他企业对其研发的信心,同时对国产创新药的“出海”积累了可借鉴的经验,期待后续有更多本土创新药在实现全球化的进程中顺利闯关。

总结
不论是Fast Follow质量与速度的稳步提升,还是差异化分子设计和临床探索的普遍化,国产创新药的竞争力正在快速增强,满足欧美标准的同时也为全球患者临床获益贡献了中国创新力量。
我们期待更多个南京传奇,不能找那些长得像他们的公司,而是要找不完全像,甚至完全不像的公司。要找那些能在“未满足的临床需求”上寻求突破的公司,无论是新靶点还是可及性。在这个资本热情退去,选择更加冷静的时代,能够走出自己创新之路的企业,才能获得更多的机会。
国产创新药,扬帆出海正当时。
参考文章:
CAR-T疗法大盘点 | 2021年国内代表企业全景图(美柏医健)
接力信达,传奇生物CAR-T疗法能逆袭成功“出海”?(药智网)
国产创新药再次叩关FDA:传奇生物CAR-T美国上市倒计时(医谷)
出海翻身仗!南京传奇CAR-T获FDA批准,背后究竟有什么「成功密码」?(药时代)
FDA批准传奇生物BCMA CAR-T:国产创新药扬帆出海正当时(医药笔记)
国内首个BIC新药国际化成功(新康界)
 识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。




 个人中心
个人中心
 我是园区
我是园区




