
本周看点
1.荣昌生物首创新药泰它西普获批上市!
2.以岭药业中药1类新药苏夏解郁除烦胶囊上市申请获受理
3.齐鲁制药2类新药孟鲁司特钠口溶膜国内获批上市!
4.百济神州PD-1抗体第6项适应症申请获CDE受理
5.拜耳PI3K抑制剂在中国申报上市
本期(3月5日至3月12日),多个新药获批上市,包括荣昌生物全球首创系统性红斑狼疮新药泰它西普获批上市,以岭药业中药 1类新药申请获受理,还有齐鲁制药2类新药孟鲁司特钠口溶膜获批上市,更多动态如下:
国内审评审批·新动态
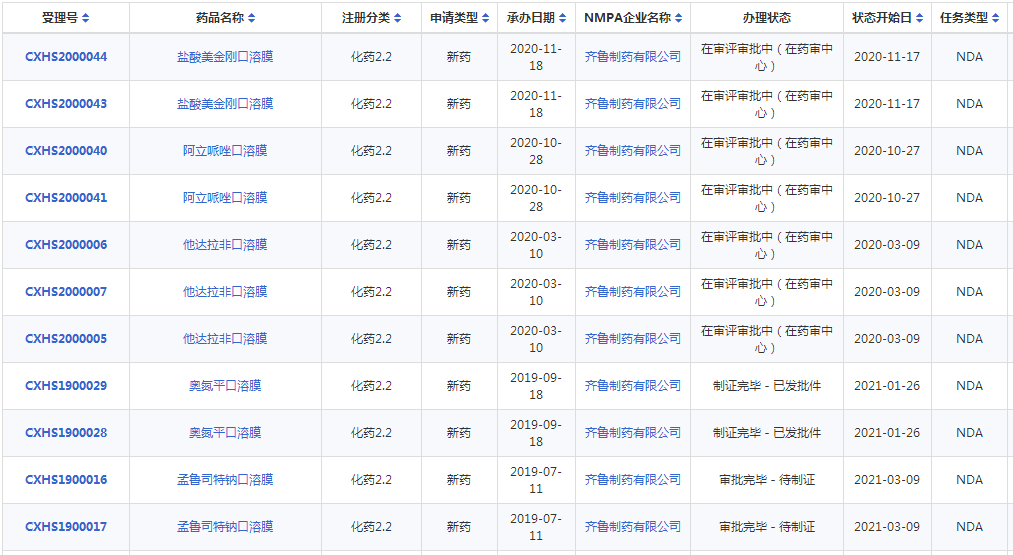
本周CDE有45个受理号(31个品种)报生产办理状态更新,其中荣昌生物注射用泰它西普和齐鲁制药孟鲁司特钠口溶膜备受关注,更多动态如下:

荣昌生物重磅新药泰它西普获批上市!
3月9日,荣昌生物自主研发的1类新药泰它西普新药获批上市,适应症为系统性红斑狼疮。泰它西普是荣昌生物研发的用于治疗自身免疫性疾病的一种新型融合蛋白,能同时抑制BlyS和APRIL两个细胞因子,具有全新的药物结构和双靶点作用机制。
荣昌生物于2010年向国家药监局申报泰它西普临床试验,2019年11月,荣昌生物的注射用泰它西普的新药上市申请正式获得CDE承办受理;2019年12月5日,泰它西普的新药上市申请获得CDE优先审评公示。同一天,国际风湿病领域年度盛会——美国风湿病学会(ACR)年会正在美国亚特兰大国际会议中心举办,荣昌生物以及北京协和医院的张奉春教授团队受邀,将泰它西普治疗系统性红斑狼疮的关键临床研究作为“最新突破性进展”在ACR大会万人主会场作口头报告。
此外,荣昌生物还在美国开发这款产品,荣昌生物计划于2021年上半年开展全球SLE的3期临床试验,包括美国、欧洲及其他国家地区。除了SLE之外,荣昌生物还在积极开展泰它西普针对六类其他B细胞介导自身免疫性疾病的后期临床试验,包括视神经脊髓炎频谱系疾病(NMOSD)、类风湿性关节炎(RA)、IgA肾炎、干燥综合症(SS)、多发性硬化症(MS)、重症肌无力(MG)等。
齐鲁制药2类新药孟鲁司特钠口溶膜国内获批上市!
近日,齐鲁制药孟鲁司特钠口腔速溶膜获国家药监局批准上市。孟鲁司特钠口溶膜是齐鲁制药按照2.2类申报的改良型新药,是孟鲁司特钠口溶膜制剂,也是齐鲁制药第二个批准上市的口腔速溶膜产品。
孟鲁司特钠是由默沙东原研开发的一种强效选择性白三烯受体拮抗剂,临床上适用于2岁至14岁儿童哮喘的预防和长期治疗,以及减轻过敏性鼻炎引起的症状。孟鲁司特是抗哮喘药大品种,原研产品有3种剂型,包括片剂、咀嚼片、颗粒。本次齐鲁制药获批的产品为全新剂型,市场潜力很大。
药智数据显示,齐鲁制药5个品种按照2.2类新药申报上市,其中奥氮平口溶膜、孟鲁司特钠口溶膜已顺利获批,还有3个口溶膜产品的新药上市申请在审评审批中,包括他达拉非口溶膜、阿立哌唑口溶膜、盐酸美金刚口溶膜。
国内审评审批·新受理
本周CDE新增报生产受理号27个,共19个品种,其中以岭药业苏夏解郁除烦胶囊和百济神州替雷利珠单抗备受关注,更多动态见下表:
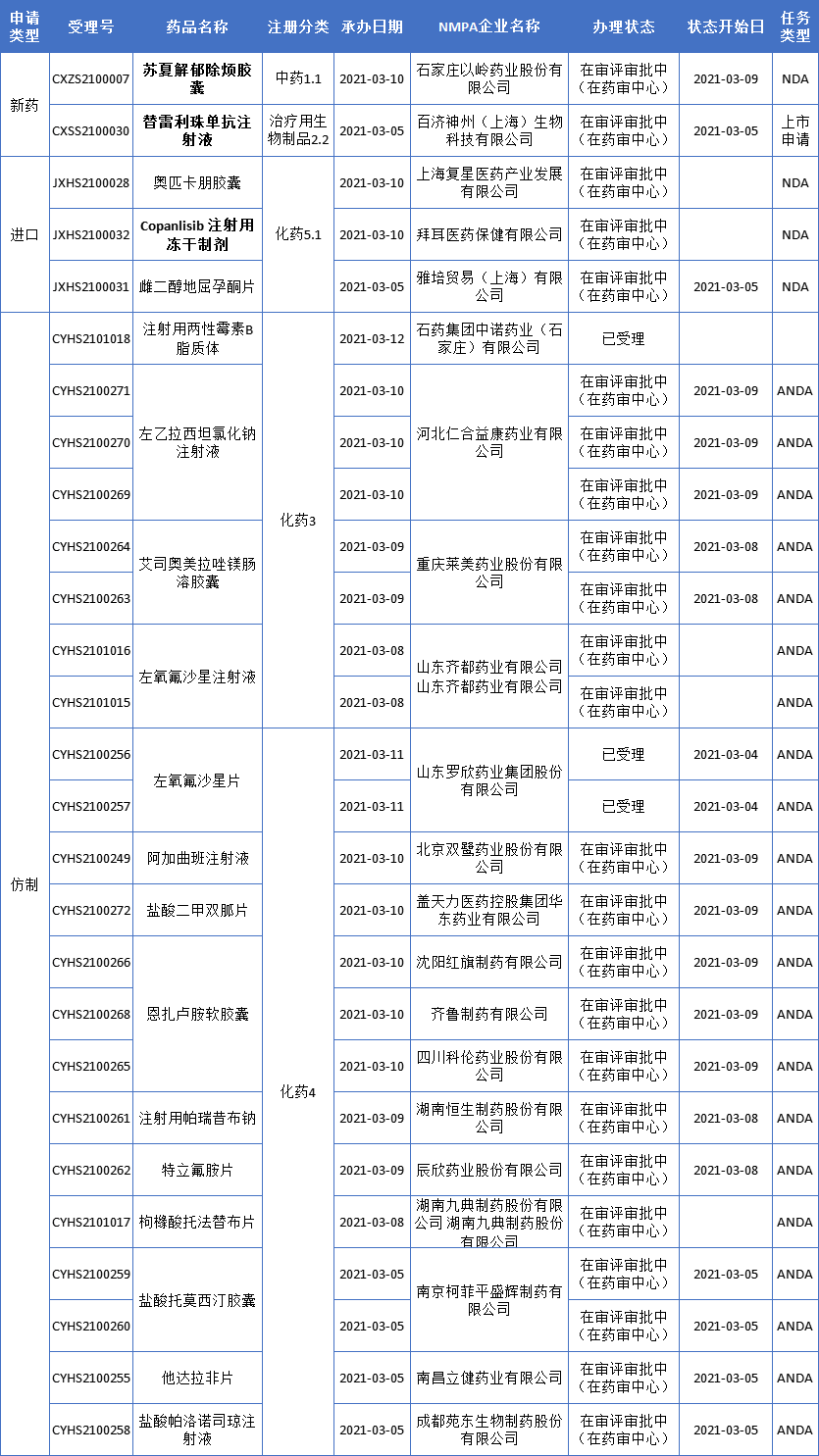
以岭药业中药1类新药苏夏解郁除烦胶囊上市申请获受理
药智数据显示,以岭药业按中药1.1类新药申报的苏夏解郁除烦胶囊已在审评审批中。据悉,苏夏解郁除烦胶囊其方源于经方,出于临床,具有清热除烦、行气化痰之功能,是疗气郁痰阻、郁火内扰型抑郁症新药。
近年来,以岭药业积极布局中药创新药,已有3款新药报产。其中,中药创新药连花清咳片于2020年5月获批上市,12月被纳入《国家医保目录》。2020年6月“益智安神片”申报新药获CDE受理,本次报产的是一款治疗抑郁症的新药苏夏解郁除烦胶囊。
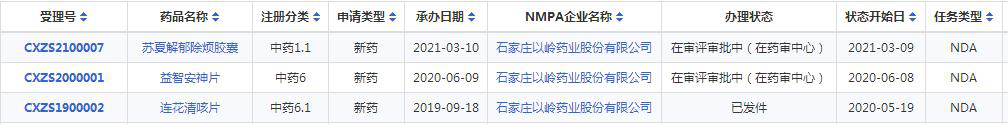
据悉,以岭药业目前已获临床批件品种涉及内分泌、泌尿系统、消化系统、风湿及精神类等疾病。此外,在研立项品种涵盖心血管系统、神经系统、呼吸系统、内分泌代谢系统、消化系统、妇科、儿科等疾病,处于临床前研究不同阶段。
百济神州PD-1抗体第6项适应症申请获CDE受理
3月5日,百济神州抗PD1抗体百泽安®(替雷利珠单抗)用于治疗接受铂类化疗后出现疾病进展的二或三线局部晚期或转移性非小细胞肺癌(NSCLC)患者的新适应症上市申请。这是百泽安申报上市的第六项适应症,也是第三项针对肺癌适应症的上市申请。
替雷利珠单抗注射液是一款人源化 lgG4 抗程序性死亡受体 1(PD-1)单克隆抗体,目前已有3项适应症获批,并有3项新适应症申请正在审评中。获批适应症包括,联合化疗用于治疗一线晚期鳞状非小细胞肺癌 (NSCLC)患者,治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者以及 PD-L1 高表达的含铂化疗失败包括新辅助或辅助化疗 12 个月内进展的局部晚期或转移性尿路上皮癌患者。正在审评中的适应症包括,联合化疗用于治疗一线晚期非鳞状 NSCLC 患者、治疗既往接受铂类化疗后出现疾病进展的二或三线局部晚期或转移性NSCLC 患者,以及治疗既往经治的不可切除肝细胞癌患者。
拜耳PI3K抑制剂在中国申报上市
3月10日,拜耳copanlisib注射用冻干制剂进口申请获CDE受理。Copanlisib是一款PI3K抑制剂,曾获得美国FDA突破性疗法认定,2017年9月,美国FDA加速批准该药用于复发性滤泡性淋巴瘤(FL)适应症。2020年12月,copanlisib注射用冻干制剂被CDE纳入突破性治疗品种名单,拟开发用于治疗既往接受过至少两线治疗的复发性MZL成人患者。
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

责任编辑 | 琉 璃
排版设计 | 惜 姌
投稿爆料 | 18523380183(同微信)
转载授权 | 18523380183(同微信)
媒体合作 | 18323856316(同微信)


期待你的
分享
点赞
在看



 个人中心
个人中心
 我是园区
我是园区




