王福生团队揭示焦亡在HIV慢性感染中的临床意义
收藏
关键词:
HIV揭示临床
资讯来源:BioArt + 订阅账号
发布时间:
2021-03-19
人类免疫缺陷病毒
(human immunodeficiency virus,HIV)
感染人体主要的靶细胞是CD4+ T细胞,由于病毒不断复制和破坏作用,感染者体内CD4+ T细胞的绝对计数逐渐下降,患者免疫力严重耗竭,发生各种机会性感染的风险增高,但是关于CD4+ T细胞减少的机制尚不完全清楚。已知细胞死亡主要有凋亡和焦亡两种形式。细胞凋亡依赖Caspase-3活化,是一种‘安静’的死亡。细胞焦亡是一种依赖于炎症小体
(inflammasome)
在感知病原或危险信号后活化炎症caspases,通过切割Gasdermin蛋白而诱发的细胞裂解,具有很强的炎症诱导能力
【1】
。此前,艾滋病患者体内CD4+ T淋巴细胞究竟通过何种方式死亡仍没有明确答案。
近日,解放军总医院第五医学中心王福生院士团队在The Journal of Clinical Investigation杂志上发表题为
NLRP3 inflammasome induces CD4+ T-cell loss in chronically HIV-1-infectedpatients
的文章,
首次阐明了艾滋病人体内细胞焦亡及其引起的持续炎症反应是CD4+ T淋巴细胞进行性减少和疾病进展的关键原因,为优化临床方案、提高临床救治有效性提供了科学依据。
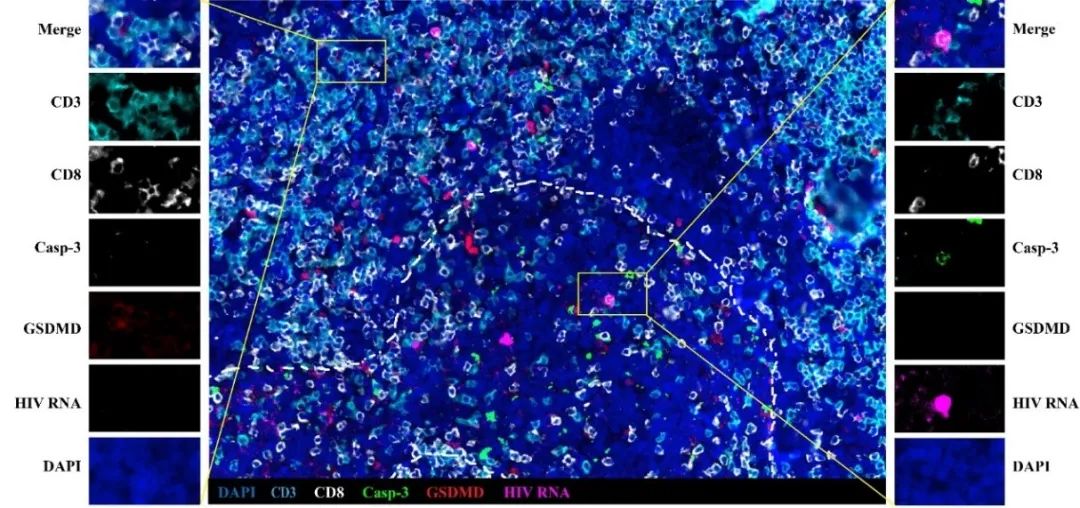
针对上述问题,研究团队分别对HIV感染者的外周血和淋巴结组织CD4+ T细胞的死亡方式进行分析。在外周血中,研究人员通过FLICA-Caspase-1和Active-Caspase-3染色分析发现,随着HIV疾病进展CD4+ T细胞的凋亡和焦亡比例均逐渐增加,且与HIV感染者体内的炎症反应呈正相关的关系。在淋巴结中,利用HIV核酸原位杂交技术、GSDMD活化特异型抗体和Caspase-3活化特异型抗体,研究人员发现发生焦亡的细胞
(活化GSDMD阳性)
主要定位在淋巴滤泡外围,且与患者HIV病毒水平密切相关。HIV阳性信号和发生凋亡的细胞
(Active-Caspase-3阳性)
主要定位于淋巴滤泡区域
(如下图)
。
该工作首次在HIV感染者体内证实之前关于CD4+ T减少机制的猜想:HIV病毒活跃复制的细胞倾向于发生凋亡;未被病毒感染的旁观者细胞容易发生焦亡
【2,3】
。
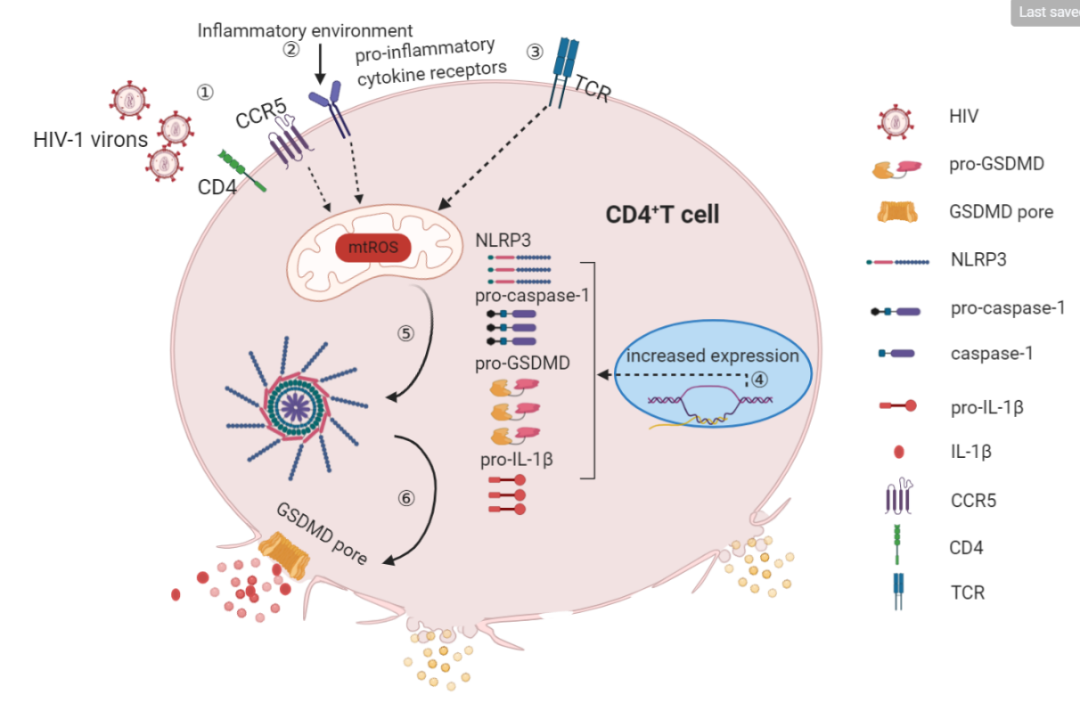
进一步体外实验发现,活性氧
(reactive oxygen species, ROS)
介导的NLRP3炎症小体活化参与了HIV诱导的CD4+ T细胞焦亡。HIV慢性感染导致患者细胞中NLRP3炎症小体相关的信号显著上调,处于易焦亡状态
(high pyroptosis-inducing potential)
。在未治疗患者中,病毒颗粒通过与CD4+ T细胞表面共受体作用
(信号1)
,不依赖建立感染即可诱导ROS活化并诱发NLRP3炎症小体介导的capsase-1活化和焦亡;在实现病毒抑制的患者中,持续的炎症
(信号2)
或TCR同源抗原刺激
(信号3)
,仍能通过该途径诱导细胞焦亡
(如下图)
。这提示NLRP3是控制HIV感染者CD4+ T细胞焦亡的潜在靶点。
综上,
该工作为理解艾滋病患者体内CD4+T细胞的减少机制提供了新的视角,并为艾滋病的治疗和以NLRP3炎症小体、焦亡为靶点的药物开发提供了理论基础。
解放军总医院第五医学中心感染病医学部主任王福生院士为本文的通讯作者,
张超
博士、
宋锦文
博士、
范兴
博士、
黄辉煌
副主任医师为共同第一作者。此工作也同时得到了北京生命科学研究
所
邵峰
院士和美国凯斯西储大学医学院
Rafick-Pierre Sékaly
教授的大力支持。
https://www.jci.org/articles/view/138861
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。
1. Galluzzi L, Vitale I, Aaronson SA, Abrams JM, Adam D, Agostinis P, etal. Molecular mechanisms of cell death: recommendations of the NomenclatureCommittee on Cell Death 2018. Cell Death Differ. 2018;25(3):486.
2. Doitsh G, Cavrois M, Lassen KG, Zepeda O, Yang Z, Santiago ML, et al.Abortive HIV infection mediates CD4 T cell depletion and inflammation in humanlymphoid tissue. Cell. 2010;143(5):789-801.
3. Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, et al. Celldeath by pyroptosis drives CD4 T-cell depletion in HIV-1 infection. Nature.2014;505(7484):509.



 药选址
药选址



