
细胞-细胞相互作用是生命过程中最基本的信息传递方式之一,尤其在免疫、神经等系统的生理过程中承担着重要的角色。在CAR-T、TCR-T等免疫疗法中,人们通过工程化改造免疫细胞,以增强其与肿瘤细胞的相互作用,实现对肿瘤的特异杀伤。发展研究细胞-细胞相互作用的工具可以帮助免疫学家更好地研究免疫过程、调控细胞治疗方法。近年来,基于“邻近标记化学”的细胞-细胞相互作用捕获技术成为一种独特的研究手段【1】,其原理是在细胞相互作用时,利用预先展示在“捕手”细胞上的标记工具,介导邻近化学反应,给周围的“猎物”细胞 “粘贴”生物素“标签”。该方法可在后续实验中通过标签筛选出相互作用过的细胞并进行深入表征。目前已经有LIPSTIC【2】,EXCELL【3】,FucoID【4】等多种基于邻近标记技术的免疫细胞间相互作用的研究方法。然而,目前这些工具全部基于邻近标记酶,缺乏时空可控性;同时其用到的探针底物较难合成或需要对免疫细胞(或小鼠)进行基因改造,技术门槛较高。此外,这些工具对细胞间相互作用的定量研究尚处于起步阶段。
2022年3月21日, 北京大学化学与分子工程学院陈鹏团队与南京大学化学化工学院李劼团队合作在J. Am. Chem. Soc.杂志发表题为Antigen-specific T cell detection via photocatalytic proximity cell labeling (PhoXCELL)的研究论文,利用光催化的小分子邻近标记工具DBF(dibromofluorescein),发展了一种快速、高效鉴定细胞-细胞相互作用的定量工具PhoXCELL(Photocatalytic proXimity CELl Labeling)。该技术可以在T细胞与树突状细胞(DC)的相互作用中,实现对抗原特异性T细胞的精确捕获。具体来说,PhoXCELL可以时空特异地捕获抗原特异性T细胞;同时,PhoXCELL还可以定量评价细胞-细胞间的相互作用,并能在肿瘤和癌旁淋巴结中同时捕获肿瘤抗原特异性CD8+和CD4+ T细胞。

需要指出的是,邻近标记的“半径”范围是在选用这类工具捕获细胞间相互作用时需要重点考虑的问题。以T细胞与靶细胞的相互作用为例,其形成的免疫突触的距离在5-25 nm【5,6】,需要选择与之匹配的邻近标记工具来高效和高选择性的标记相互作用细胞。Sortase,Fucosyltransferase等酶在邻近标记时,需要与对面细胞上的底物进行结合,标记范围过小;而APEX,TurboID等酶产生的活性中间体虽然可以在一定范围内扩散,但其半衰期较长(约100 μs),可标记范围过大【1】。与其他活性中间体相比,基于单线态氧的邻近标记过程(半衰期约200 ns, 扩散半径约30 nm【7】)更加适用于T细胞与靶细胞之间相互作用的捕捉。在标记过程中,单线态氧可以氧化蛋白质上富电子的氨基酸侧链,这些被氧化的氨基酸进一步被带有亲核基团的生物素标签进攻。本文中,作者选择了一种常用的、生物兼容性好且稳定易合成的化学小分子单线态氧引发剂-DBF(dibromofluorescein)作为细胞表面邻近标记的催化剂。
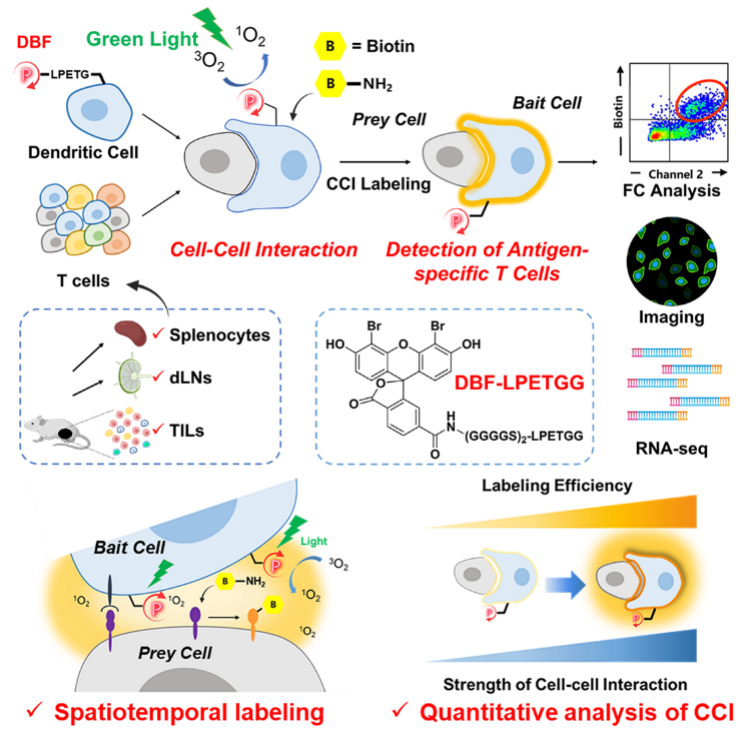
图1. 利用PhoXCELL捕获抗原特异性T细胞的技术路径
首先,作者利用此前所开发的mgSrtA酶介导的连接反应【3】将DBF小分子以非基因编码的方式展示在“捕手”细胞上,成功构建了带有DBF催化剂的DC细胞,并通过筛选亲核探针、标记条件等,得到了在细胞表面进行邻近标记的最佳方案。然后,作者利用OT-I T细胞对OVA257-264(SIINFEKL)抗原的特异性识别作用,成功的利用SIINFEKL-DBF-DC在OT-I小鼠的脾脏细胞中捕获到了特异性相互作用的OT-I细胞。这种抗原特异性T细胞的捕获可以在十分钟内完成,并且可以利用光的开启和暂停进行切换,实现时-空可控。共聚焦成像实验证明标记的探针信号确实存在于相互作用的免疫突触上,证明了标记的空间特异性。
T细胞与靶细胞间不同强度的相互作用决定了T细胞的命运,例如,肿瘤中不同强度的新抗原会产生不同的T细胞响应【8】;通过调控CAR-T细胞与癌细胞的相互作用强度可以减少CAR-T细胞的耗竭【9】。进一步地,作者利用对OT-I TCR具有不同亲和性的OVA257-264突变抗原肽构建不同相互作用强度的模型系统,详细研究了PhoXCELL的标记信号是否可以定量的反映细胞间相互作用的强度。通过分析相互作用后T细胞上激活分子CD69的表达情况以及标记信号,作者发现邻近标记信号强度随相互作用强度变化的趋势与CD69的表达水平变化趋势一致,证明邻近标记的信号强度可以反映细胞间相互作用的强度。通过对不同强度相互作用T细胞的转录组分析发现,相比于标记信号弱的细胞(相互作用弱),标记信号强的细胞(相互作用强)上调了与细胞分化、通讯、活化、黏连以及细胞因子分泌相关基因的表达,进一步证明相互作用强度对T细胞分化的影响。
最后,作者利用PhoXCELL技术在小鼠三阴性乳腺癌模型E0771中捕获肿瘤相关抗原特异性T细胞。通过将DBF展示在吞噬并递呈有肿瘤抗原的DC上,作者成功的在肿瘤浸润淋巴细胞(TILs)和癌旁淋巴结中同时捕获到了肿瘤抗原特异性CD8+和CD4+ T细胞。被捕获到的细胞均高表达PD-1和CD39,且ELISPOT实验进一步证明,这群细胞确实可以特异性识别肿瘤相关抗原。
综上,该研究开发了一种光催化的细胞-细胞相互作用捕获新工具PhoXCELL,可以时空特异、定量地捕获细胞间相互作用,成功实现对抗原特异性T细胞的高效捕获。
北京大学化学与分子工程学院、北大-清华生命科学联合中心陈鹏教授和南京大学化学化工学院、化学和生物医药创新研究院(ChemBIC)李劼教授为该论文的共同通讯作者,北京大学化学与分子工程学院博士研究生刘宏宇、博士后罗惠鑫为该论文的共同第一作者,南京大学化学化工学院硕士研究生薛琪等对论文亦有重要贡献。
原文链接:
https://doi.org/10.1021/jacs.2c00159
参考文献
1. Bechtel, T. J., Reyes-robles, T., Fadeyi, O. O. & Oslund, R. C. Strategies for monitoring cell – cell interactions. Nature Chemical Biology 17, 641–652 (2021).
2. Pasqual, G. et al. Monitoring T cell-dendritic cell interactions in vivo by intercellular enzymatic labelling. Nature 553, 496–500 (2018).
3. Ge, Y. et al. Enzyme-Mediated Intercellular Proximity Labeling for Detecting Cell–Cell Interactions. Journal of the American Chemical Society 141, 1833–1837 (2019).
4. Liu, Z. et al. Detecting Tumor Antigen-Specific T Cells via Interaction-Dependent Fucosyl-Biotinylation. Cell 183, 1117–1133 (2020).
5. de La Roche, M., Asano, Y. & Griffiths, G. M. Origins of the cytolytic synapse. Nature Reviews Immunology 16, 421–432 (2016).
6. Choudhuri, K., Wiseman, D., Brown, M. H., Gould, K. & van der Merwe, P. A. T-cell receptor triggering is critically dependent on the dimensions of its peptide-MHC ligand. Nature 436, 578–582 (2005).
7. Jacobson, K., Rajfur, Z., Vitriol, E. & Hahn, K. Chromophore-assisted laser inactivation in cell biology. Trends in Cell Biology 18, 443–450 (2008).
8. Burger, M. L. et al. Antigen dominance hierarchies shape TCF1+ progenitor CD8 T cell phenotypes in tumors. Cell 184, 4996-5014.e26 (2021).
9. Weber, E. W. et al. Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling. Science 372, (2021).
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




