▎药明康德内容团队编辑
上周,美国FDA加速批准了强生(Johnson & Johnson)旗下杨森(Janssen)公司开发的双特异性抗体
(amivantamab-vmjw)上市,用于治疗携带EGFR外显子20插入突变的非小细胞肺癌患者(NSCLC)。对于这一患者群体来说,这是FDA批准的首款精准疗法。对于双特异性抗体开发领域来说,这一批准也代表着一个里程碑。这是FDA首次批准一款靶向不同肿瘤抗原的双特异性抗体疗法。今日,美国FDA又发布了针对双特异性抗体开发的指南,对业界开发这一创新治疗模式提供了指导建议。
双特异性抗体顾名思义,是一种能够与两种不同抗原特异性结合的抗体。它可以与不同抗原结合的特征赋予了这一类分子很大的灵活性。目前,已经有上百种双特异性抗体进入临床开发阶段。此前,安进(Amgen)公司的双特异性T细胞结合器(BiTE)Blincyto(blinatumomab)已经获得FDA批准治疗血液癌症。罗氏(Roche)开发的双特异性凝血因子IXa和因子X抗体
图片来源:123RF
在双特异性抗体的开发领域,最先出现的也是目前最常见的抗体类型是将两种不同细胞连接在一起的双特异性抗体,这些抗体的一端与一种细胞表面的特异性抗原结合,另一端与另外一种细胞表面的特异性抗原结合,从而将两种不同的细胞拉近到一起,促使它们之间产生相互作用。这种双特异性抗体的代表之一就是T细胞接合器(T cell engager)。
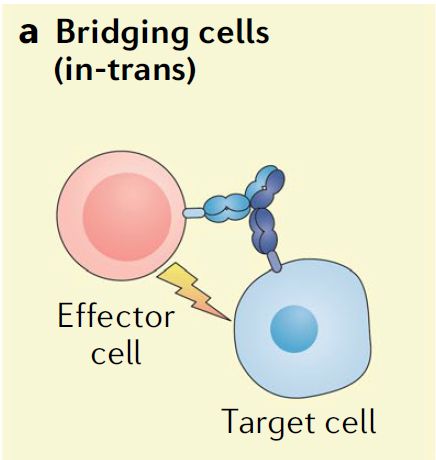
▲连接两种不同细胞的双特异性抗体(图片来源:参考资料[3])
安进公司的
就是这种类型的分子,它也是首个获得FDA批准的双特异性抗体。它的一端与B细胞表面表达的CD19抗原结合,另一端与T细胞表面的CD3受体相结合,从而将T细胞募集到癌细胞附近,促进它们杀伤癌细胞。
如今,已经有数十款通过与CD3受体结合的双特异性抗体处于临床试验中,作为治疗血液癌症的免疫疗法,在近几年的美国血液学会(ASH)年会上,
在治疗不同血液癌症方面表现出良好的效果。与同样利用T细胞杀伤癌细胞的CAR-T疗法相比,T细胞接合器的治疗具有更大的灵活性。
在今年即将举行的ASCO年会上,也有多款T细胞接合器将汇报最新临床结果。例如,今日,杨森公司宣布,其靶向B细胞成熟抗原(BCMA)和CD3的双特异性抗体teclistamab在治疗接受过多种前期治疗的复发/难治性多发性骨髓瘤(R/R MM)患者的1期临床试验中获得积极结果。在中位随访时间为6.1个月时,接受2期临床试验推荐剂量的患者的总缓解率达到65%,其中40%的患者达到完全缓解,中位缓解持续时间尚未达到。
该公司开发的另一款靶向GPRC5D的潜在“first-in-class”双特异性抗体疗法talquetamab在治疗R/R MM 患者的1期临床试验中也达到70%的总缓解率,包括60%的非常好的部分缓解(VGPR)。
由于双特异性抗体的灵活性,通过改变它能够结合的抗原,它可以用于募集包括先天杀伤细胞(NK cells)在内的其它免疫细胞,也可以用于靶向实体瘤表达的抗原。目前,靶向HER2,PSMA等实体瘤表达抗原的T细胞接合器已经处于临床开发阶段。
近日获批的Rybrevant代表着双特异性抗体的另一种作用模式,这种作用模式让双特异性抗体与同一细胞表面表达的不同蛋白相结合。例如,Rybrevant可以与EGFR和MET结合。靶向与癌症相关的酪氨酸受体激酶(RTK)的策略虽然在治疗多种癌症方面已经取得了良好的效果,但是耐药性的产生一直是限制这些靶向疗法疗效的主要因素之一。而产生耐药性的一种重要机制是提高其它RTK的表达,替代受到抑制的信号通路。例如,在非小细胞肺癌患者中,MET信号通路的激活能够让患者对EGFR抑制剂产生耐药性。作为一款同时靶向EGFR和MET的双特异性抗体,Rybrevant可以同时阻断这两条信号通路。它还可以通过抗体依赖性细胞介导的细胞毒性(ADCC)进一步杀伤癌细胞。
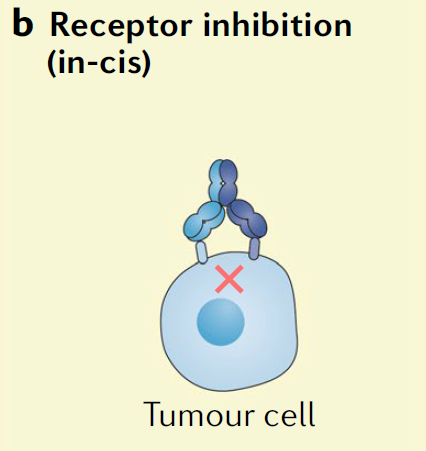
▲靶向同一细胞表面不同抗原的双特异性抗体(图片来源:参考资料[3])
利用这一机理的多款双特异性抗体也已经进入临床开发阶段,其中包括同时靶向CD19和CD22的双特异性抗体,以及靶向HER2和HER3的双特异性抗体等等。
另一种双特异性抗体的设计模式是让它能够与同一个抗原的不同表位相结合。Zymeworks开发的HER2靶向双特异性抗体
就是这样一个例子。它能够与HER上两个非重叠表位相结合。这种独特的设计让同一个HER2受体能够与两个抗体相结合。这种作用机制能够促进HER2受体的聚集、内化以及降解,提高阻断HER2信号传导的效率。此外,它还能增强抗体介导的细胞毒性作用。它已经获得FDA的突破性疗法认定,用于治疗HER2阳性胆道癌。它与化疗联用,在一线治疗HER2阳性胃食管腺癌(GEA)的临床试验中达到54%的确认客观缓解率。百济神州已经与Zymeworks达成成协议,共同开发这一创新疗法。
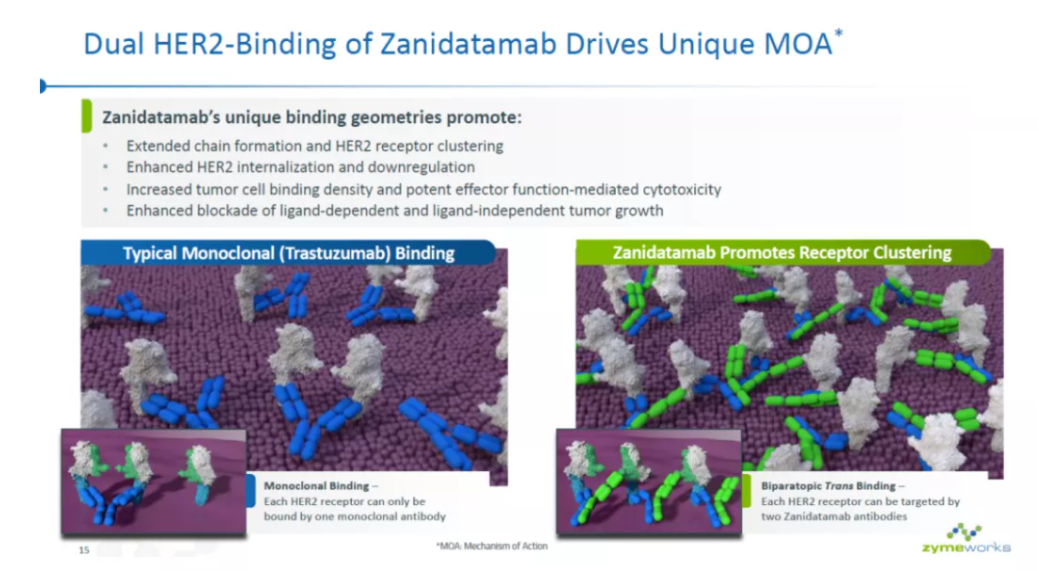
▲Zanidatamab具有独特的作用机制(图片来源:Zymeworks官网)
今日,美国FDA发布了帮助医药产业和其它利益攸关方开发双特异性抗体的指南,对双特异性抗体开发的多个方面提供了指导。FDA表示,总体来说,双特异性抗体疗法的开发在很多方面与单克隆抗体疗法的开发相仿,但是双特异性抗体由于其结构的特殊性和复杂性,可能需要具有针对性的指导。点击文末“阅读全文/Read more”,即可下载FDA指南全文。

FDA指出,在双特异性抗体的开发过程中,由于双特异性抗体结构的复杂性和独特性,可能激发人体的免疫反应,因此需要对双特异性抗体的免疫原性进行评估。
临床前研究需要提供足够证据来证明双特异性抗体开发的科学依据,例如阻断两个靶点可能产生叠加或协同效应,或者连接两个受体能够产生单特异性产品无法产生的疗效。
在临床开发时,FDA指出,虽然大多数情况下对双特异性抗体的临床研究可以与标准治疗或安慰剂进行比较,但是如果已经有单特异性产品获得批准治疗同样的适应症,那么可以考虑进行临床研究,将双特异性抗体和单特异性产品进行比较。这种比较可能为双特异性抗体的获益/风险评估提供有用的信息。如果FDA认为这种研究有利于获得关于双特异性抗体效力或安全性的有用信息,可能要求开发商进行这种类型的研究。
虽然目前只有三款疗法获得FDA的批准
,但是双特异性抗体疗法正在成为治疗肿瘤、炎症性疾病以及其它疾病类型的一种重要治疗模式。除了本文列出的三种作用模式,它们还具有帮助大分子穿越血脑屏障,作为辅助因子激活信号级联通路等多种其它作用模式。我们期待这种创新治疗模式在未来为更多患者造福。
参考资料:
[1] Janssen Presents Updated Data on First-in-Class Talquetamab at ASCO Suggesting Deep and Durable Responses in Heavily Pretreated Patients with Multiple Myeloma. Retrieved May 24, 2021, from https://www.businesswire.com/news/home/20210524005457/en
[2] Janssen’s Updated Phase 1 Results for Teclistamab Suggest Deep, Durable Responses in Patients with Heavily Pretreated Multiple Myeloma. Retrieved May 24, 2021, from https://www.businesswire.com/news/home/20210524005459/en
[3] Labrijn et al., (2019). Bispecific antibodies: a mechanistic review of the pipeline. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-019-0028-1
[4] Bispecific Antibody Development Programs Guidance for Industry. Retrieved May 24, 2021, from https://www.fda.gov/regulatory-information/search-fda-guidance-documents/bispecific-antibody-development-programs-guidance-industry
[5] Bispecific Antibody Development Programs Guidance for Industry. Retrieved May 24, 2021, from https://www.fda.gov/media/123313/download
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。










 个人中心
个人中心
 我是园区
我是园区




