
7 月 21 日,君实生物宣布其 PD-1 单抗药物特瑞普利单抗用于治疗鼻咽癌获得欧盟委员会(EC)授予的孤儿药资格认定,该决定基于欧洲药品管理局(EMA)的赞成意见。截至当前,特瑞普利单抗已累计获得欧盟和美国药品监管机构授予的 6 项孤儿药资格认定,涉及黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌及小细胞肺癌治疗领域。

来自:上市公司公告
鼻咽癌是一种原发于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部肿瘤之一。据世界卫生组织统计,2020 年全球鼻咽癌新发病例数超过 13 万。由于原发肿瘤位置的原因,很少采用手术治疗,局部疾病患者主要采用化疗及放疗治疗。在美国和欧洲,尚无免疫疗法获批用于治疗鼻咽癌。
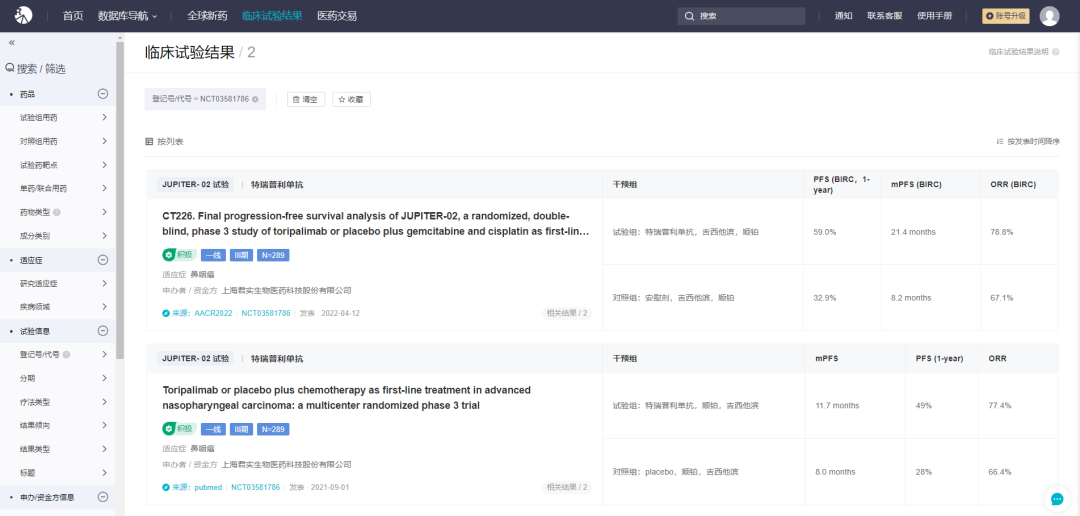
在鼻咽癌治疗领域,君实生物已完成两项关键注册临床研究——JUPITER-02 研究(一项随机、双盲、安慰剂对照、国际多中心 III 期临床研究)和 POLARIS-02 研究(一项多中心、开放标签、II 期临床研究),贯穿了复发/转移性鼻咽癌的一线至后线治疗。
特瑞普利单抗鼻咽癌适应症开发甘特图

来自:Insight 数据库网页版 - 全球新药模块(http://db.dxy.cn/v5/home/)
点击文末「阅读原文」即可获取数据库免费试用福利
其中,JUPITER-02 研究成果于 2021 年 6 月以「重磅研究摘要」形式(#LBA2)入选美国临床肿瘤学会年会(ASCO 2021)全体大会,随后作为《自然-医学》杂志(Nature Medicine,IF: 87.241)2021 年 9 月刊的封面文章发表。POLARIS-02 研究成果于 2021 年 1 月获得《临床肿瘤学杂志》(Journal of ClinicalOncology,IF: 50.717)在线发表(相应临床详细数据附于文末)。
基于上述两项研究结果,2021 年特瑞普利单抗的两项鼻咽癌新适应症获得 NMPA 批准在中国上市,成为全球首个获批鼻咽癌治疗的免疫检查点抑制剂。美国 FDA 亦针对其鼻咽癌适应症授予 2 项突破性疗法认定和 1 项孤儿药资格认定,并于 2022 年 7 月受理了重新提交的特瑞普利单抗用于治疗鼻咽癌的生物制品许可申请(Biologics License Application,以下简称「BLA」),如获批准,特瑞普利单抗将成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物。
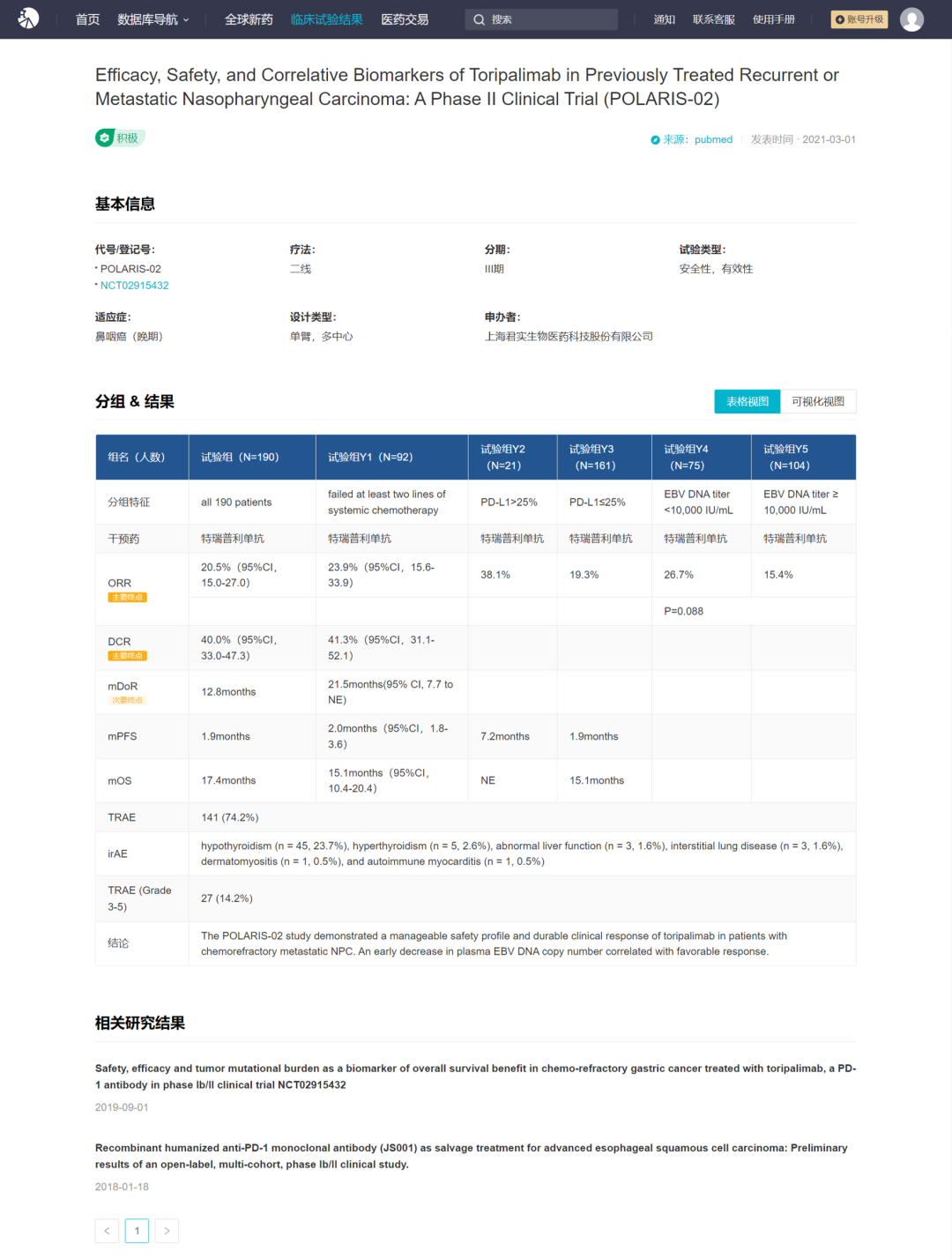
附:特瑞普利单抗鼻咽癌临床数据
1、POLARIS-02 临床试验结果








 个人中心
个人中心
 我是园区
我是园区




