您还不是认证园区!
赶快前去认证园区吧!


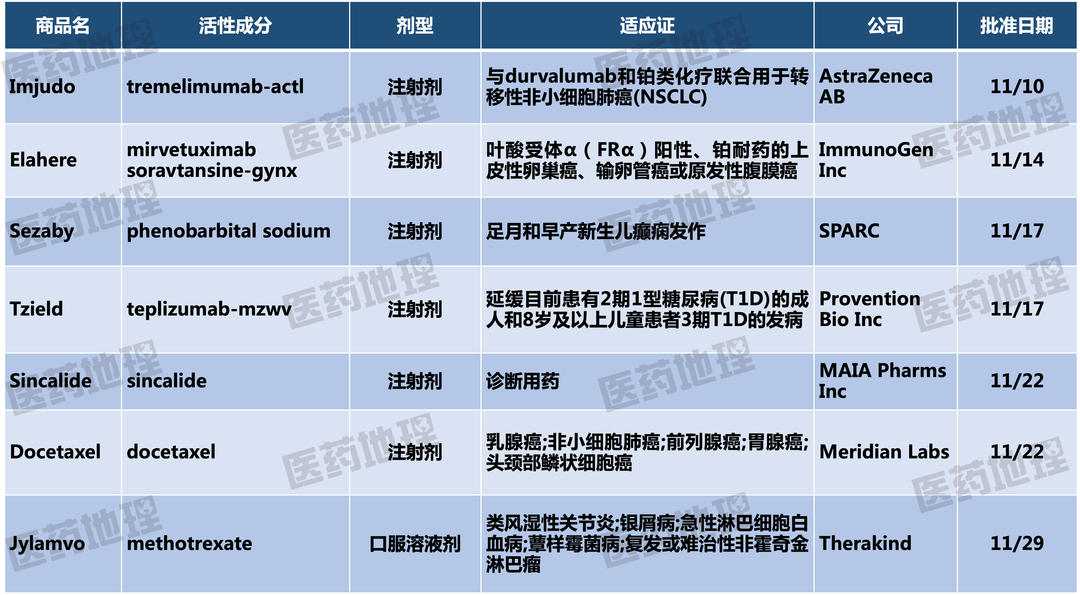

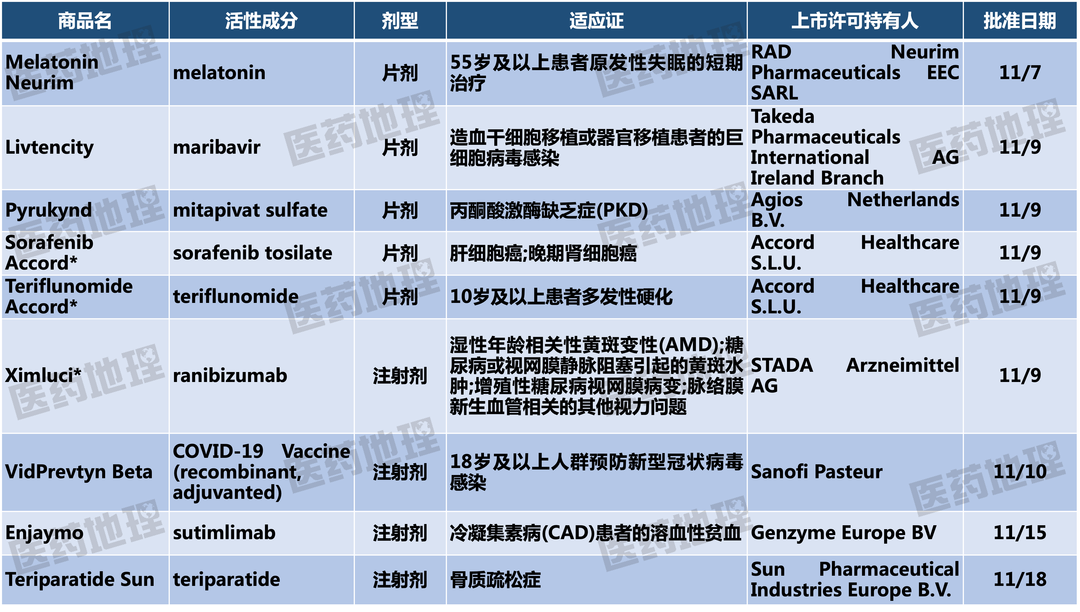

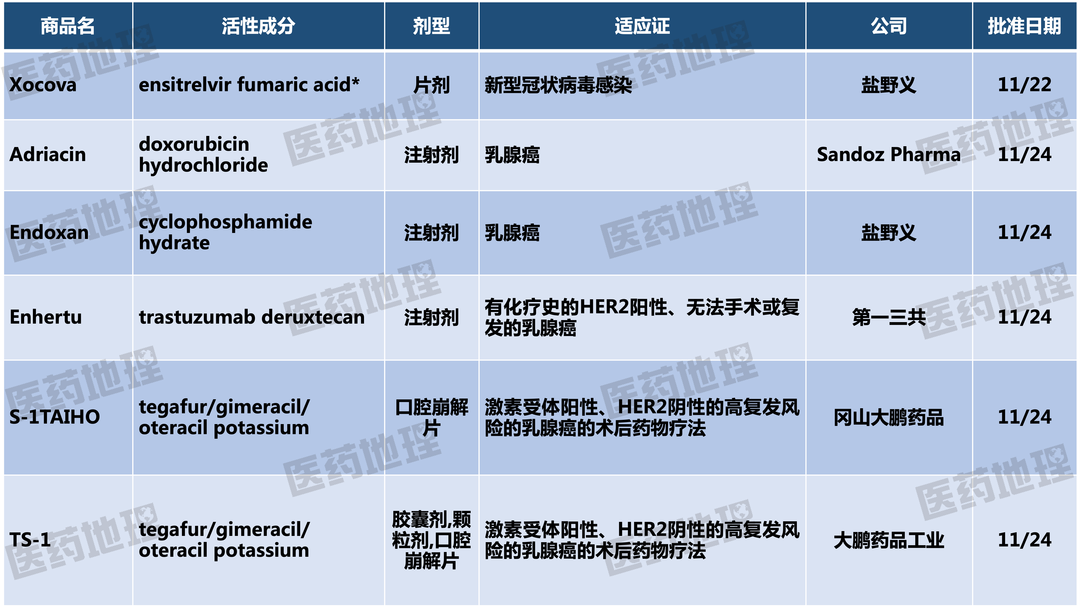
封面图来源:123rf




出海、资本寒冬、CXO、ADC......2022年药圈十大关键词!哪一个戳中了你?

卖部门、自愿暂停所有管线、濒临破产,为了通用型CAR-T和实体瘤CAR-T

资本寒冬里,我们一起重温王健博士解读的「新药研发投融资之春夏秋冬四季」!

我们在冬天里欢聚,一起讲述春天的故事!——第二届中国新药领袖闭门交流会成功举办!
推荐阅读
-
我在Nature上,找到了这些值得在2023年关注的事......
-
FDA今年批准上市的创新疗法大盘点:TCR双抗、国产CAR-T……
-
出海、资本寒冬、CXO、ADC......2022年药圈十大关键词!哪一个戳中了你?
-
AI制药新锐GLP-1RA小分子口服药物获美国FDA临床批件,用于治疗肥胖症
-
无论怎么看,94.75亿美元的BD交易都是里程碑式的
-
卖部门、自愿暂停所有管线、濒临破产,为了通用型CAR-T和实体瘤CAR-T
-
资本寒冬里,我们一起重温王健博士解读的「新药研发投融资之春夏秋冬四季」!
-
沙利文发布:中国首个白血病领域CAR-T产品NDA受理,掀起商业化新浪潮
-
我们在冬天里欢聚,一起讲述春天的故事!——第二届中国新药领袖闭门交流会成功举办!
-
第四届“健康中国思南峰会”在沪召开:数字化转型推动医疗健康产业变革

 药时代BD高阶研讨会火热报名中!
药时代BD高阶研讨会火热报名中!



 个人中心
个人中心
 我是园区
我是园区




