
点评 | 王延江(陆军军医大学大坪医院)、竺淑佳(中国科学院脑科学与智能技术卓越创新中心)
唐氏综合征
(Down syndrome,
DS
)
,又称21-三体综合征,是先天性智力障碍的最常见原因,我国约有100万唐氏患者。厦门大学医学院王鑫教授团队长期致力于唐氏综合征的分子机制和治疗靶点研究,鉴定发现多个唐氏综合征的潜在治疗靶点
【1-3】
。除了神经系统的症状,唐氏患者一个典型的病理特征是免疫系统功能异常,表现为自身免疫性疾病、炎症性疾病和血液系统恶性肿瘤的易感性增加。
2023年3月2日,厦门大学王鑫教授团队在Cell期刊发表了题为
β2-microglobulin functions as an endogenous NMDAR antagonist to impair synaptic function
的研究成果,
解析了唐氏综合征外周免疫与中枢神经系统病理的关联,为理解唐氏认知损伤的机制提供了全新视角。
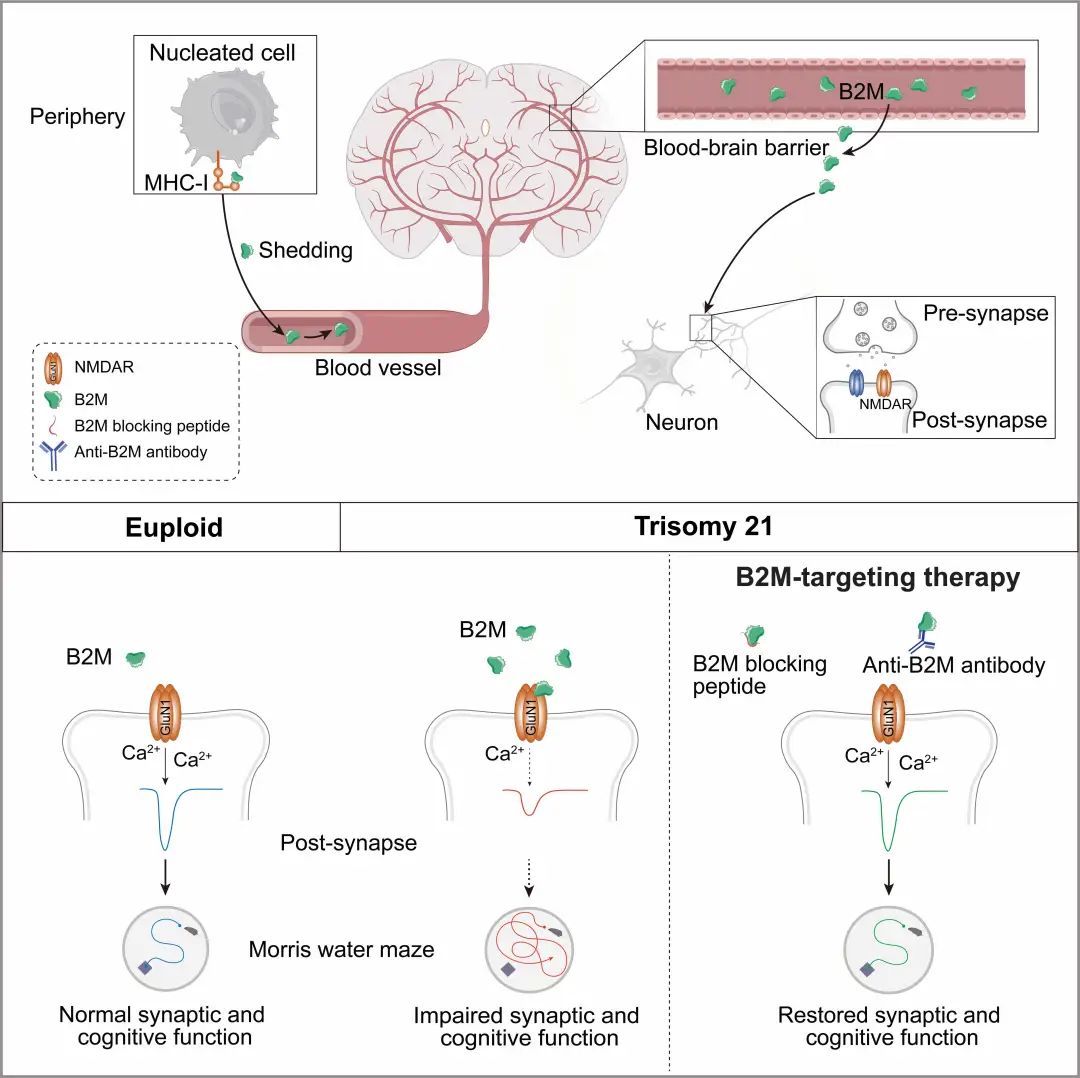
该研究中,王鑫教授团队通过连体共生手术将唐氏小鼠模型Dp16和野生型小鼠建立血液共享,发现唐氏小鼠血液会损害野生型小鼠的突触功能。为了检验小鼠实验结果的临床关联性,研究人员将唐氏患者血浆注射到免疫缺陷小鼠体内,得到同样的结果,证明了唐氏血浆中存在导致突触损伤的成分。经过研究团队的努力,最终找到了唐氏血浆中导致突触损伤的元凶——β2-微球蛋白
(
B2M
)
。B2M是主要组织相容性复合体I
(MHC-I)
的组成亚基,经典功能是将抗原信息提呈给T细胞。此外,B2M也可以从MHC-I上脱落,以游离的形式存在体内。
利用双光子成像技术,研究团队发现,血中游离的B2M可以穿过血脑屏障,进入脑实质
,且脑中约一半的B2M来源于外周。研究人员通过尾静脉注射抗体中和唐氏小鼠血中游离的B2M,显著改善了唐氏小鼠的突触和认知功能,证实了外周的B2M参与调控唐氏认知损伤。
B2M在大脑中的功能是否也依赖于MHC-I呢?为了解答这个问题,研究团队在MHC-I缺陷的Tap1−/−小鼠和T细胞受体
(TCR)
缺陷的Tcrb−/−;Tcrd−/−小鼠上进一步验证,发现B2M同样可以损伤这两种小鼠的突触功能,证实了B2M对突触和认知功能的损伤不依赖于MHC-I和TCR。
利用蛋白质谱技术,研究团队找到了B2M在脑中的作用靶点——NMDA受体,并发现了B2M通过结合NMDA受体GluN1亚基从而抑制受体功能。通过一系列电生理和分子生物学实验,研究团队筛选出了可以竞争性阻断B2M与GluN1结合的多肽GluN1-P2
;脑内注射GluN1-P2可以显著恢复NMDA受体功能,并逆转唐氏小鼠的突触损伤
。此外,在衰老的过程中,游离的B2M蛋白水平会显著升高,研究团队发现GluN1-P2多肽同样可以逆转衰老相关突触损伤
。在多种导致认知损伤的疾病状况下,均有B2M水平显著增加,如阿尔茨海默病和感染等,本研究发现的B2M作用模式可能是多种认知障碍疾病的共有病理机制。
综上所述,
该研究揭示了唐氏综合征中外周免疫参与中枢神经系统损伤的分子机制,发现了B2M拮抗NMDA受体的非经典功能,为认知障碍疾病提供了新的治疗思路和药物靶点
(图1)
。
图1. 外周B2M参与中枢神经系统突触损伤的机制示意图
厦门大学医学院神经科学研究所、细胞应激生物学国家重点实验室王鑫教授为本论文通讯作者,厦门大学医学院博士后高月为第一作者,助理教授郑秋阳、博士生洪育娟、张海彬、硕士生黄莉红和郑爽等也对本文作出了重要贡献。本研究还得到了厦门大学韩家淮院士、林圣彩院士、中科院深圳先进技术研究院孙坚原研究员和中科院脑科学与智能技术卓越创新中心竺淑佳研究员的帮助和宝贵建议。
最后,研究团队特别致谢厦门大学
许华曦
教授的支持和帮助。许华曦教授于2022年10月因病逝世,他一生致力于神经退行性疾病的致病机制和治疗学研究,在阿尔茨海默病研究领域作出了重要贡献。
许华曦
教授为厦门大学神经科学研究所的创始所长,对厦门大学的神经科学学科成长和发展做出了重要的贡献,本论文研究人员对许华曦教授致以最高的敬意和深切的缅怀。
王延江
(陆军军医大学大坪医院神经内科,教授、主任医师)
唐氏综合征,是最常见的染色体异常疾病,患者主要症状为智力障碍、发育迟缓和免疫系统缺陷等。此外,唐氏患者在40岁以后均会出现类似阿尔茨海默病的神经病理特征。寻找唐氏认知损伤的病理机制和治疗手段,对于阿尔茨海默病的研究同样具有重要参考意义。以往的研究主要侧重于对唐氏综合征大脑自身功能缺陷的分析,而厦门大学王鑫教授团队则首次从外周角度揭示了唐氏认知障碍的致病机制。通过小鼠连体共生模型和唐氏患者血浆注射等方法,王鑫教授团队证明了唐氏患者和小鼠模型的血浆均会损伤正常小鼠的学习记忆和突触功能,而罪魁祸首是唐氏患者血液中过多的免疫蛋白B2M;通过连体共生或抗体中和等方式降低外周B2M均能有效逆转唐氏认知损伤。此外,该研究在转化方面也做了大量探索,验证了B2M抗体和阻断肽治疗唐氏认知缺陷的临床应用价值。该研究不仅揭示了全新的唐氏综合征认知障碍分子机制,也为从系统角度探索唐氏综合征和相关认知障碍疾病的干预靶点和治疗策略提供了重要方向和新的思路。
竺淑佳
(中国科学院脑科学与智能技术卓越创新中心,研究员)
NMDA受体是大脑内一类离子型谷氨酸受体家族,参与突触传递及可塑性,调控认知情绪等重要脑功能。突触上功能性的NMDA受体通常由两个甘氨酸结合的必须GluN1亚基和两个谷氨酸结合的可变GluN2亚基组成异源四聚复合体。NMDA受体功能异常与多种神经及精神类疾病密切相关,解析病理状态下NMDA受体受内源性分子的调控机制对于理解认知疾病机理和治疗药物开发具有重要的意义。
唐氏综合征作为常见智力障碍疾病,患者的一个重要病理特征为大脑中的兴奋/抑制平衡状态遭到破坏,但具体机制一直以来并不清楚。本研究中,厦门大学王鑫教授团队独辟蹊径,从免疫系统与神经交互作用角度,发现了唐氏外周血液中免疫分子B2M能通过血脑屏障,抑制神经元上NMDA受体的活性。他们结合一系列电生理记录和分子生物学技术,发现了B2M通过与GluN1亚基结合抑制NMDA受体功能;进一步通过结构/序列分析和功能筛选,获得了可以竞争性阻断B2M与GluN1结合的多肽GluN1-P2。该多肽不仅可以减轻唐氏小鼠的突触功能障碍,对于其它认知损伤状态,如衰老小鼠的突触功能缺陷也有较好的改善效果。该项工作开创性地提出了外周免疫系统与神经系统互作的分子机制,通过B2M与NMDA受体的病理性结合,进而影响学习与记忆的神经生物学机制,为认知损伤疾病的药物研发提供了全新思路。
王鑫教授课题组主要致力于认知障碍疾病的致病机理和药物靶点的研究,近五年以通讯作者在Cell、J Clin Invest、Sci Adv、Mol Psychiatry、Natl Sci Rev、PLoS Biol等国际知名学术期刊发表多篇研究论文。王鑫教授课题组因工作需要,热忱欢迎具有神经科学/细胞生物学/免疫学背景的博士后加入,同时欢迎优秀学子报考厦门大学医学院研究生。
https://jinshuju.net/f/ZqXwZt
或扫描二维码
投递简历
原文链接:
https://doi.org/10.1016/j.cell.2023.01.021
制版人:十一
1 Wang, X. et al. Loss of sorting nexin 27 contributes to excitatory synaptic dysfunction by modulating glutamate receptor recycling in Down's syndrome. Nat Med 19, 473-480, doi:10.1038/nm.3117 (2013).
2 Zheng, Q. Y. et al. Trisomy 21-induced dysregulation of microglial homeostasis in Alzheimer's brains is mediated by USP25. Science Advances 7, doi:10.1126/sciadv.abe1340 (2021).
3 Zheng, Q. et al. USP25 inhibition ameliorates Alzheimer's pathology through the regulation of APP processing and Abeta generation. J Clin Invest 132, doi:10.1172/JCI152170 (2022).

【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。












 个人中心
个人中心
 我是园区
我是园区





