单细胞蛋白质分析技术科研突破集锦—解析肿瘤、免疫和干细胞异型性
收藏
关键词:
免疫突破细胞肿瘤瘤
资讯来源:BioArt + 订阅账号
发布时间:
2022-05-31
早在2017年“人类细胞图谱计划”已经公布,致力于描绘一个健康人的所有细胞的参考图谱,将组织群体细胞水平研究推进到单个细胞异质性研究,从单细胞转录组学到单细胞蛋白质组学。目前单细胞测序技术已经应用到肿瘤、肿瘤免疫、生殖发育、干细胞和神经科学等多个领域。尽管近年来高通量单细胞基因组和转录组分析已迅速发展以解决细胞异质性问题,但研究发现单细胞中RNA和蛋白质水平之间的相关性较差。蛋白质在细胞关键活动中发挥重要作用,在内外部环境控制下,蛋白质表达差异影响细胞分化、神经传导、免疫反应和疾病发生,是生命活动变化的重要指标。由于基因表达的随机性,具有相同基因的细胞RNA和蛋白质拷贝数发生变异,这表明单细胞蛋白质组学和转录组学分析之间的脱节以及进行单细胞蛋白质组学分析的必要性。
所以单细胞蛋白质分析可为细胞异质性提供重要的见解,与单细胞转录组测序配合,更好的阐述细胞异质性问题。
单细胞蛋白质分析挑战在于蛋白质组巨大复杂性和低丰度,要求检测技术必须具有多重性、高通量和高灵敏度,才能提供准确蛋白定量信息。
ProteinSimple单细胞蛋白质分子技术
:Milo是一种基于微流体的芯片电泳技术,可克服单细胞蛋白质分析方法面临的挑战。
将细胞悬浮液加载到Milo芯片上,这样单个细胞就可以安放在芯片上的各个微孔中。然后Milo裂解细胞,产生单细胞裂解物,通过分子量电泳分离每个单细胞裂解物中的蛋白质,然后使用紫外线在Milo芯片中捕获蛋白质。然后,对目标蛋白进行一级抗体和荧光二级抗体进行免疫荧光捕获。通过使用开放格式的微阵列扫描仪对芯片进行成像,并使用Scout™软件对图像进行分析,以进行定量的自动数据分析。
诱导多能干细胞(induced pluripotent stem cells, iPSC)的疾病模型用于新药发现、药物效价测试、预测药物安全性药理学/毒理学研究,以及基于iPSC的再生细胞疗法,有望治疗心脏病、帕金森、视网膜和角膜疾病、肝脏衰竭、糖尿病、脊髓损伤等疾病。然而将iPSC治疗方法真正有效转化为临床环境,保证患者安全,iPSC 谱系表型细胞和细胞系变异的异质性是需要解决的问题。
hiPSC分化和建立心肌细胞(cardiomyocytes,CMs)为实现人类心脏再生疗法创造了可能性。可用于治疗心血管疾病,还可用于模拟人类心脏发育和疾病、研究潜在机制以及筛选具有疗效和心脏毒性的新药。
但hiPSC-CM由不同的细胞亚群组成,异质性程度高,导致心室样、心房样和节点样亚群,需要严格表征hiPSC-CM,并对其成熟度、特征和功能进行筛选,进行单细胞深入研究这种异质性。
与免疫荧光和流式细胞术等其他单细胞分析系统不同,单细胞Western Blot技术Milo可以提供分子量大小信息,以及在单细胞水平测量蛋白质表达时的免疫结合信息,赋予额外的特异性。这种分子量分级步骤可分辨不同物种不同蛋白质亚型或区分脱靶抗体结合。为了表征CMs亚型标志物,通过Milo检测了肌球蛋白调节轻链2心房亚型(MLC2A或MYL7)及其心室亚型(MLC2V或MYL2)蛋白质表达。可观察到Milo鉴定了三个亚群,这些亚群由MLC2A或MLC2V单一表达或共表达组成。
在hiPSC-CM亚群中检测整个分化过程中每个标记物的表达水平变化,第17、23和30天对hiPSC-CM分化的MLC2V和MLC2A表达进行了量化。随着分化进行,MLC2A的总水平略有增加。然而,MLC2V表达在第23天和第30天之间增加了近三倍(图C)。为了了解驱动MLC2V表达增加的细胞亚群,三个亚群(MLC2A+、MLC2V+和共表达MLC2A+和MLC2V+)被进一步分层(图D)。MLC2V的水平在共表达MLC2A+和MLC2V+亚群中显着增加,以及在单独的MLC2V+亚群中增加。
hiPSC-CM正被用于心血管疾病和心脏发育研究,但hiPSC-CM由不同细胞亚群组成,并且hiPSC-CM蛋白表达动力学随着成熟而波动,一些蛋白分析方法可能因为分辨率不足而无法检测单细胞蛋白异质性,因此hiPSC-CM单细胞蛋白质组学可能受到依赖抗体结合检测而无法评估脱靶结合技术限制。单细胞蛋白质分析技术Milo,通过靶点分子量差异和抗体识别特异性蛋白标记物,避免了抗体脱靶结合现象,同时能够跟踪单细胞亚群蛋白表达随时间变化,从而能够识别并量化hiPSC-CM中不同的异质性亚群,应用于疾病建模和再生医学治疗研究。
Nature文章利用Milo检测B-ALL单细胞磷酸化蛋白
本研究揭示了急性B淋巴细胞白血病(B-ALL)新型抗癌机制,分析了1148例患者的急性B淋巴细胞白血病(B-ALL)样本,发现单个基因突变不会促进白血病发生,除非它们在表征B细胞分化阶段单一致癌途径。与主要致癌驱动因子不一致的突变则会激活不同信号通路,从而直接破坏B细胞转化。B-ALL中致癌病变通常模仿前B细胞阶段的细胞因子受体(通过激活信号转导蛋白STAT5)或更成熟细胞中前B细胞受体中(通过激活蛋白激酶ERK)的信号传导。STAT5和ERK激活性病变很常见,但二者仅在约3%的病例中同时发生。单细胞突变和磷酸化蛋白分析显示致癌的STAT5和ERK激活与竞争性克隆分离。STAT5和ERK参与相反的生化和转录过程,且分别由转录因子MYC和BCL6调控。当不同信号通路被重激活时,主要致癌驱动因子受到抑制,从而逆转了B细胞转化。相反,不同途径组分的缺失会加速白细胞生成。因此,不同信号通路的持久性成为了B细胞转化的强大障碍,而在一个主要驱动因素上的趋同则促使了白血病发作。不同信号通路的药理学重激活,可以与抑制主要致癌驱动因子产生协同作用。因此,差异信号通路的重新激活可以作为先前未被认可的策略来增强B-ALL治疗反应。
Milo检测结果发现,STAT5和ERK双通路激活的概率为2%,与双细胞落空率相当,故在同一个细胞中发生双通路激活几乎不可能,STAT5和ERK激活信号通路互不兼容。
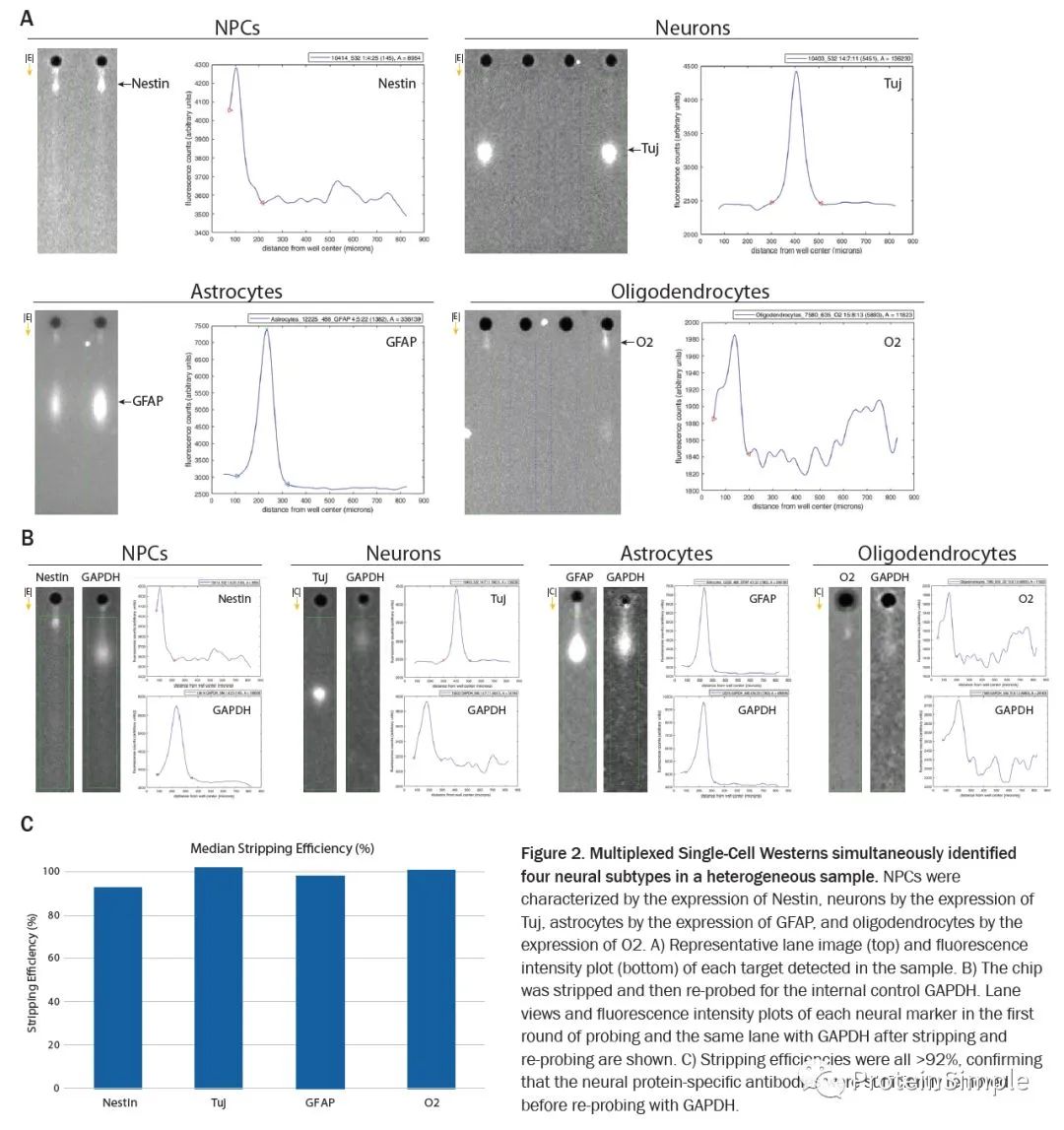
中枢神经系统(CNS)包含神经元和非神经元细胞,这些神经元和非神经元细胞协同工作以协调运动,处理感官信息并执行认知任务。CNS细胞均源自神经干细胞,先分化为神经祖细胞,继而发育为包括神经元,星形胶质细胞和少突胶质细胞等神经细胞亚型。
根据细胞形态识别出单个神经细胞,需要根据单个细胞中神经元谱系的蛋白标记物进行分类。然而,由于长轴突和卷曲树突的神经元形态复杂,使用传统的单细胞分析工具流式细胞术难以分析神经元。因为流式细胞术很难将信号与单个细胞体区分开。如果需要目标阳性细胞的百分比并进行统计分析,免疫荧光和其他单细胞成像技术也会带来挑战。
Milo能够鉴别并量化样品中神经细胞亚型的百分比,并基于亚型特异性标志物表达分析跟踪分化进程,动态分析多功能干细胞(iPSC)向神经元,星形胶质细胞和少突胶质细胞的分化过程。
多重单细胞蛋白质检测法同时鉴定了每种分化的异质神经样品中的四种主要神经细胞类型(NPC,星形胶质细胞,神经元和少突胶质细胞),以及在原芯片上strip掉蛋白标记,重新进行了GAPDH检测。Milo可同时检测芯片strip效率(剥离效率均高于92%)。
Milo单细胞蛋白质定量分析技术来源于美国加州大学伯克利分校,该技术数据已经发表在Nature Communication、Nature method、 Nature Protocol,PNAS、Science、Cell、Cell Stem Cell等一系列顶级杂志上,在肿瘤靶向药物研究、iPSC干细胞分化发育、胚胎发育、免疫细胞分化等领域内都有极其重要的意义。
方式一扫描下方二维码,填写信息索取单细胞Western Blot~产品资料!

方式二
关注
ProteinSimple公众号
:找到“关于我们”→ “BioArt”,填写信息索取单细胞Western Blot~产品资料!
Lixing Liu,etc. Advances of Single-Cell Protein Analysis. Cells 2020, 9, 1271
Current Challenges of iPSC-Based Disease Modeling and Therapeutic Implications.
Human induced pluripotent stem cell-derived cardiomyocytes: insights into molecular, cellular, and functional phenotypes.
Single-cell protein expression of hiPSC-derived cardiomyocytes using Single-Cell Westerns.
Lai N. Chan, etc. Signalling input from divergent pathways subverts B cell transformation. Nature, July 22,2020











 个人中心
个人中心
 我是园区
我是园区




