近年来,晚期非小细胞肺癌(NSCLC)靶向治疗取得了极大的进展,分子分型是NSCLC靶向治疗的前提,选择准确、快速、恰当的检测方法,及时筛查出靶向治疗受益人群是医患共同关注的焦点。随着近期RET等罕见靶点药物的获批,需要常规检测的NSCLC靶向治疗靶点越来越多,多基因联合检测已成为临床现实迫切需求。近日,该领域传来重磅消息!
近日,日本药品和医疗器械管理局(PMDA)以肿瘤靶向治疗伴随诊断标准,批准了艾德生物PCR-11基因产品在日本上市,用于指导多个肺癌靶向药物的临床应用。这是继肺癌ROS1伴随诊断产品之后,艾德生物再次在日本获批伴随诊断产品,并且是多基因联合检测产品。该产品的获批,标志着中国体外诊断企业,在肿瘤伴随诊断的国际舞台上实现领跑。
PCR-11基因产品是艾德研发密切结合中国肺癌专家诊疗实践的智慧结晶,产品囊括了EGFR、HER2、KRAS、BRAF、MET、ALK、ROS1、RET、NTRK1-3共11个肺癌核心驱动基因,覆盖了《非小细胞肺癌分子病理检测临床实践指南(2021版)》中推荐检测的所有靶向治疗基因。基于简单、方便、快捷的PCR技术平台的产品设计,有助于临床快速且全面地筛查出靶向治疗受益人群,及时构建肺癌快诊快治体系,打造肺癌诊治的“中国速度”。此次PCR-11基因产品获得PMDA批准,也标志着中国肺癌快速诊治模式已获得国际认可,进入国际推广阶段。
中国智造的硬核品质
日本是全球第三大体外诊断市场,以注重品质和法规严苛著名,肿瘤伴随诊断是体外诊断领域的竞争高地,在日本注册该类产品的挑战之高可想而知。艾德生物的PCR-11基因产品凭借着充分符合临床价值的设计和临床验证中展示出的优异性能,赢得了日本药监部门的认可,让中国体外诊断产品有机会站上日本市场高地,助力中国肺癌诊治智慧成果进入国际临床应用。
根据日本PMDA公布的产品说明书,艾德生物PCR-11基因产品展现出中国智造的硬核品质,在与日本国内已获批上市试剂的临床对比研究中,无论和哪个技术平台的产品对比,艾德生物PCR-11基因产品均展现出高度的一致性,检测性能优异。
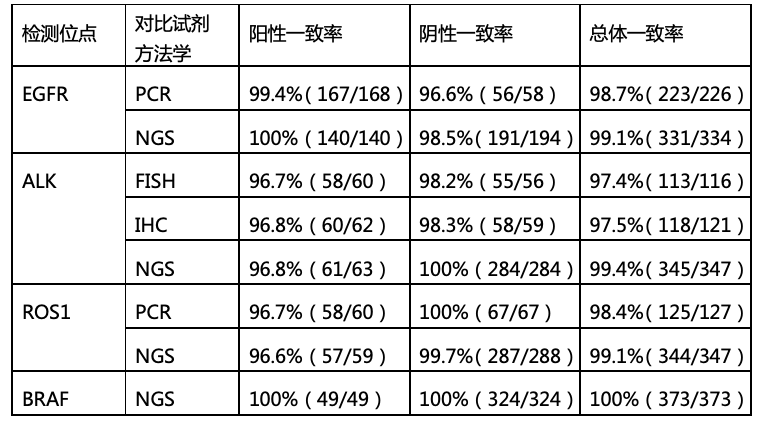
临床性能和应用体验的双重保障
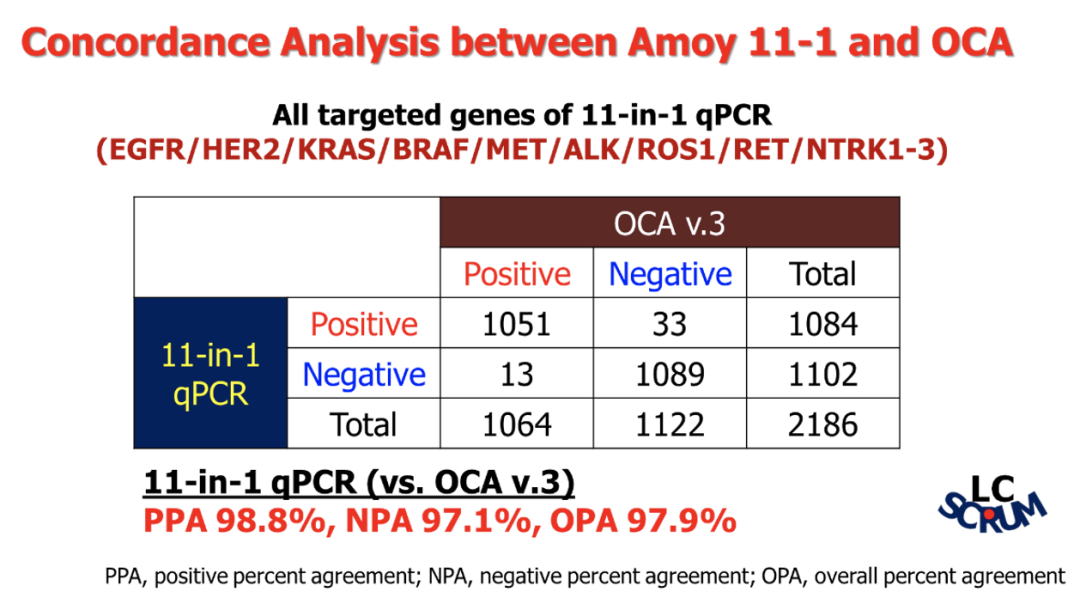
在今年的世界肺癌大会上,日本国家癌症中心的后藤功一教授报告了亚洲个体化医学癌症基因筛查项目(LC-SCRUM-Asia)数据,也印证了该产品的优异性能。在两千多例的肺癌患者肿瘤样本头对头对比检测分析中,艾德生物PCR-11基因产品在与OncomineTM Comprehensive Assay(OCA v3, Thermo Fisher)NGS产品的检测结果展现出高度一致性,总符合率97.9%、阳性符合率98.8%、阴性符合率97.1%。
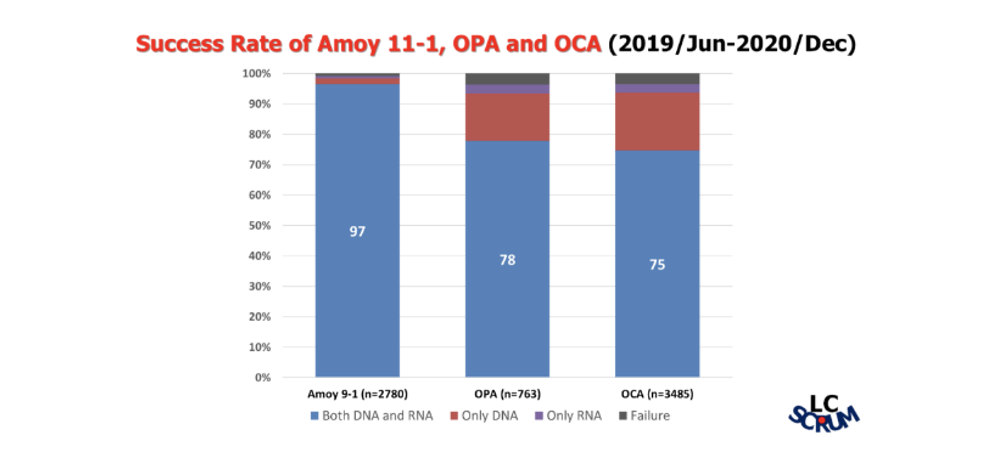
进一步的对比结果显示:1)艾德生物的PCR-11基因产品在检测成功率方面优势明显:同时检测DNA和RNA的成功率达97%,远高于对照NGS产品(来自Thermo Fisher的50基因和161基因产品,成功率分别为75%和 78%);2)艾德生物的PCR-11基因检测报告周期短:中位检测周期仅为3天,远比NGS方法检测周期短,更加适合用于晚期NSCLC患者的一线快速诊断。

国际品质,惠及国内
与此同时,做为国内现有PCR多基因联合检测产品的升级版,艾德生物正积极推进该PCR-11基因伴随诊断产品在国内的注册报批工作,相信在不久的将来,新的创新产品必将惠及广大国内肺癌患者。
随着我国各地区肿瘤分级诊疗制度实施、肿瘤多学科会诊普及与规范、众多靶向药物相继降价并进入医保,治疗费用支付问题将不再是挡在患者抗癌道路上的“大山”,“精准治疗、检测先行”的肿瘤诊疗模式将更加普及,能够有助于院内普及和规范化,简便、快速且价格适当的伴随诊断产品将更能满足绝大多数患者的临床检测需求。
艾德生物坚持从患者需求出发,致力于将技术创新转化为合规的高品质分子诊断产品。本次日本获批的PCR-11基因伴随诊断产品完全符合以上精准诊疗模式和应用场景需求,将进一步推动我国众多医院肺癌分子病理检测能力的的普及和规范,使得更多肺癌患者能够在家门口的医院得到合规、保质、快速的伴随诊断检测。PCR-11基因必将在我国肺癌规范化精准诊疗实践中成为“国际品质、中国质造”的知名好产品!
排版编辑:Kaela



 个人中心
个人中心
 我是园区
我是园区




