▎药明康德内容团队编辑
近日,Santhera Pharmaceuticals与ReveraGen BioPharma联合宣布完成向美国FDA滚动递交新药申请(NDA),并寻求其在研药品vamorolone用于治疗杜氏肌营养不良(DMD)的优先审评资格。Vamorolone为潜在治疗DMD的“first-in-class”疗法。若获批,vamorolone将有可能于美国2023年下半年上市。

DMD是一项罕见的X-染色体连锁遗传疾病,是由于在X染色体上编码抗肌萎缩蛋白(dystrophin)的基因出现突变而导致,因此几乎只影响男性患者,是最常见的儿童神经肌肉疾病之一。DMD特征为在出生时或出生后短时间内出现炎症反应,进而导致肌肉纤维化,以及临床上肌肉的萎缩与退化。疾病进展的里程碑包含患者丧失步行与进食能力,以及需要呼吸辅助与心肌疾病的产生。由于呼吸与/或心脏衰竭之故,DMD患者的预期寿命通常不超过40岁。皮质类固醇(corticosteroids)是DMD儿童与成人患者的标准治疗药物,然而这些激素虽然可以延缓疾病进展,但却具许多副作用。
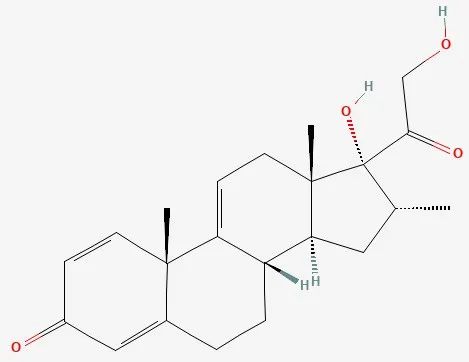
▲Vamorolone化学结构式(图片来源:PubChem)
Vamorolone是一款在研药物,虽然可与之结合的受体与皮质类固醇相同,但能够具选择性地激活类固醇的某些信号通路,因此被认为属于“游离型(dissociative)”抗炎症药物。亦即在引发抗炎症效果的同时,具潜力避免(“游离”)传统类固醇所带来的安全性顾虑与副作用,进而可能取代现有疗法。Vamorolone获得美国与欧洲用以治疗DMD的孤儿药资格,并获得美国FDA快速通道资格与罕见儿科疾病认定。此药物具潜力成为“first-in-class”游离型类固醇疗法。
这次申请递交主要基于来自VISION-DMD关键临床2b期试验的积极结果,其中包含:
与安慰剂和强的松(prednisone,0.75 mg/kg/day)相比,以vamorolone(2、6 mg/kg/day)治疗24周的疗效与安全性。
24周试验检视药物疗效的维持,并持续收集长期安全性与耐药性数据。
4项开放标签试验(包含延伸试验),在其中病患使用2、6 mg/kg/day剂量的vamorolone治疗,最长达30个月。另外亦包含一项外部对照组试验。
“完成vamorolone的新药申请递交对我们而言,是将这项在研疗法带给DMD患者重要的一步,而这也代表Santhera一项重要的里程碑,”Santhera的首席执行官Dario Eklund先生说道,“我们期待与美国的监管单位密切合作,共同促进vamorolone的批准。”
药明康德为全球生物医药行业提供一体化、端到端的新药研发和生产服务,服务范围涵盖化学药研发和生产、生物学研究、临床前测试和临床试验研发、细胞及基因疗法研发、测试和生产等领域。如您有相关业务需求,欢迎点击下方图片填写具体信息。
▲如您有任何业务需求,请长按扫描上方二维码,或点击文末“阅读原文/Read more”,即可访问业务对接平台,填写业务需求信息



分享,点赞,在看,聚焦全球生物医药健康创新



 个人中心
个人中心
 我是园区
我是园区




