Nat Cardiovasc Res | 邓伟豪团队揭示GSDMD依赖的血小板焦亡加剧脓毒症中NET形成和炎症
收藏
关键词:
揭示Nat炎症
资讯来源:BioArt + 订阅账号
发布时间:
2022-08-05

责编 | 兮
脓毒症
(sepsis)
是全球公认高发病率和高致死率的公共卫生问题。全球每年约5000万例脓毒症患者,其对不同年龄段的人群都有影响,其中儿童脓毒症是导致全球范围内儿童死亡,发病和巨大医疗费用的主要原因
【1】
。脓毒症的临床治疗在很大程度上仍是对症支持治疗,如控制感染源、及时使用抗生素、复苏和器官功能障碍的支持性治疗,但效果有限且容易病程加重,给患者带来严重的经济负担和恐慌。
早期对脓毒症的研究只是关注于免疫细胞的功能失调,缺乏对其他关键致死因素如血小板与免疫细胞相互作用调控炎症的系统研究。血小板
(platelets, PLTs)
是由骨髓成熟巨核细胞产生的一种无细胞核的循环细胞
(2-4 μm大小,7-10天寿命)
。越来越多证据表明血小板作为一种关键的免疫细胞促进脓毒症的发生发展,包括参与血栓形成、血小板减少以及中性粒细胞胞外杀菌网
(neutrophil extracellular traps,
NETs
)
形成
【2】
。近年来,NLRP3炎症小体途径介导细胞焦亡扩大炎症反应受到广泛研究者关注。细胞焦亡
(pyroptosis)
,是由炎症或感染引起的一种程序性细胞死亡,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应
【3,4】
。已有研究报道血小板具备炎症小体的成分NLRP3和ASC,提示血小板可能存在NLRP3调控的细胞焦亡病理过程。但是血小板是否发生焦亡,及其如何参与脓毒症的急性恶化病理过程尚不明确。
2022年8月4日,广州医科大学附属广州市妇女儿童医疗中心邓伟豪团队在Nature Cardiovascular Research期刊上发表了文章
Gasdermin D-dependent platelet pyroptosis exacerbates NET formation and inflammation in severe sepsis
,揭示了血小板及其介导的NET形成在脓毒症发病机制。本研究利用临床标本、细胞和血小板特异性Gsdmd敲除小鼠、S100a9敲除小鼠及Tlr4敲除小鼠等实验,明确血小板焦亡对NETs的影响,阐明血小板焦亡与NETs存在正反馈回路的分子机制,证实阻断该正反馈能对抗过度炎症,为脓毒症的机制研究和防治提供新的视角和靶点。
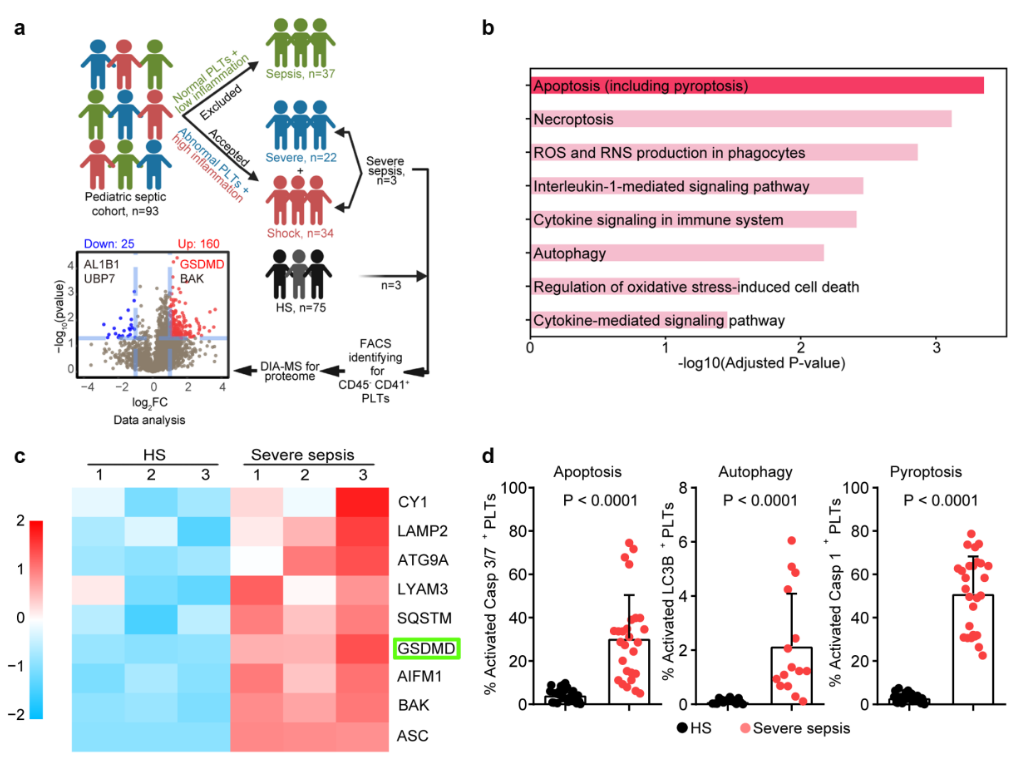
本研究首先利用蛋白质组学测序、透射电镜、免疫荧光、流式细胞术等技术在血液-细胞-分子等多层面探讨了血小板是否存在焦亡。研究者发现,脓毒症患者的GSDMD
(炎症诱导细胞焦亡的执行分子)
表达显著上调,同时利用血小板特异性Gsdmd基因敲除小鼠建立的盲肠穿孔结扎手术
(cecal ligation and puncture, CLP)
诱导脓毒症模型中证实了GSDMD是触发血小板焦亡的必要调控分子,同时揭示了脓毒症条件下存在血小板新的病理过程即NLRP3/caspase-1/GSDMD信号通路激活的血小板焦亡
(图1)
。
为进一步解析严重脓毒症中过度炎症反应的分子机制,研究者结合已有文献提示和运用三种不同的敲除基因小鼠模型
(Gsdmd-/-,Tlr4-/-和S100a9-/-)
,阐明了脓毒症来源的S100A8/A9通过激活TLR4信号通路诱导GSDMD依赖的血小板焦亡,释放线粒体的ox-mtDNA,从而介促进NET形成。此外,研究者证明了NET释放S100A8/A9,进一步诱导GSDMD依赖的血小板焦亡,形成了一个正反馈回路
(图2)
,从而导致炎症因子风暴的产生。
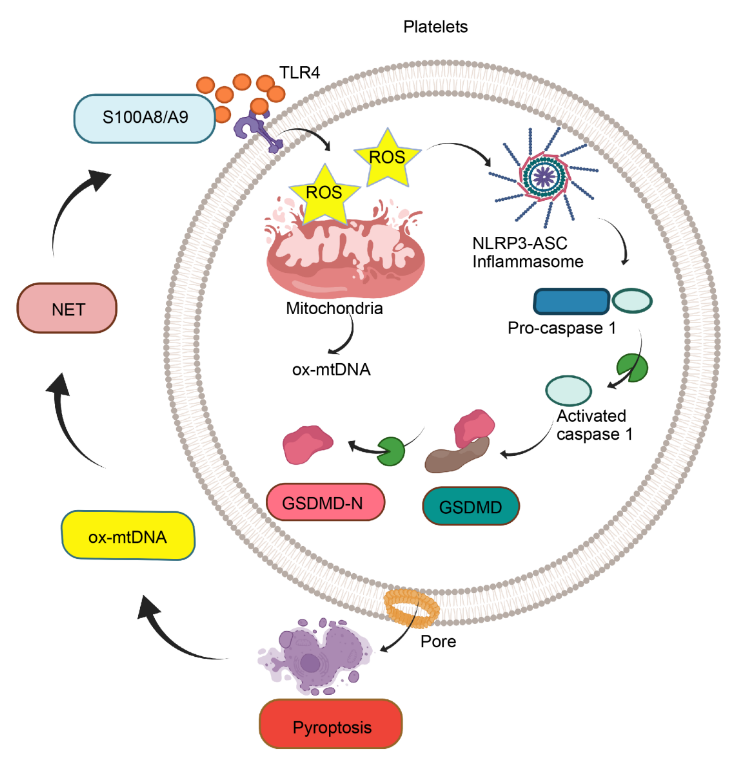
图2. 血小板焦亡-NET的正反馈回路加剧严重脓毒症的炎症反应
该研究首次证实了在严重脓毒症中S100A8/A9通过上调TLR4/NLRP3信号通路诱导GSDMD依赖的血小板焦亡。
血小板焦亡通过释放的ox-mtDNA促进NET形成。反之,NET通过分泌的S100A8/A9进一步诱导血小板焦亡,即形成一种有害的正反馈回路加剧感染后的炎症反应
(图3)
。因此,评估血小板焦亡将作为严重脓毒症病程中的一种预后或诊断辅助手段。尤其是在严重脓毒症并发大量血小板焦亡的患儿中,通过靶向S100A8/A9或血小板特异性的GSDMD可能是一种非常必要的辅助治疗方法。
广州医科大学附属广州市妇女儿童医疗中心苏妹玲博士和陈超飞博士为第一作者,王萍主任医师、美国耶鲁大学John Hwa教授和邓伟豪教授为通讯作者。
https://www.nature.com/articles/s44161-022-00108-7
制版人:十一
1. Cecconi, M., Evans, L., Levy, M. & Rhodes, A. Sepsis and septic shock. Lancet 392, 75-87 (2018).
2. Vardon-Bounes, F., et al. Platelets Are Critical Key Players in Sepsis. Int J Mol Sci 20(2019).
3. Fink, S.L. & Cookson, B.T. Apoptosis, pyroptosis, and necrosis: mechanistic description of dead and dying eukaryotic cells. Infect Immun 73, 1907-1916 (2005).
4. He, W.T., et al. Gasdermin D is an executor of pyroptosis and required for interleukin-1beta secretion. Cell Res 25, 1285-1298 (2015).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。






 药选址
药选址




