BioNews | ProQR:眼内注射RNA疗法在罕见眼科疾病临床数据良好,计划开始两项关键性试验
收藏
关键词:
临床眼科临床数据疗法疾病注射
资讯来源:蹊之美股生物医药 + 订阅账号
发布时间:
2021-03-25
微信公众号:蹊之美股生物医药 / CaesarBiotech
1、QR-421a在多种视觉测量方法,包括最佳矫正视觉活动(BCVA),静态视野检查和视网膜成像(OCT))中显示出一致的益处
3、两项关键的2/3期试验预计将于2021年底开始
ProQR Therapeutics NV(纳斯达克股票代码:PRQR)(以下简称“公司”),一家致力于遗传性视网膜病的转化RNA疗法公司,今天发布了,QR-421a用于治疗USH2A基因13号外显子突变,导致的Usher综合征和非综合征性色素性视网膜炎(nsRP)成人患者,1/2期Stellar试验分析结果。该试验中,QR-421a单次给药后,在多个视觉协调一致测试中显示获益,包括视敏度,视野和光学相干断层扫描(OCT)视网膜成像。QR-421a的耐受性良好,未报告严重不良事件。基于这些发现,公司计划在2021年底之前将QR-421a推进至两项平行的、关键性、2/3期临床试验,一项针对早期中度患者,一项针对晚期患者。
QR-421a是一款first-in-class在研RNA疗法,通过眼内玻璃体注射给药,旨在解决因USH2A基因外显子13突变,而导致2a型Usher综合征和非综合征性色素性视网膜炎视力丧失的根本原因。QR-421被设计为通过外显子跳跃方法,恢复功能性Usherin蛋白,以停止或逆转患者的视力丧失。
Results from the Phase 1/2 trial of QR-421a
所有剂量的QR-421a耐受性良好。没有严重不良事件的报道,也没有观察到炎症发生。在治疗和未治疗组中,各有一例患者既往存在的白内障加重。研究者认为两者均与治疗无关。一名患者既往存在的囊状黄斑水肿(CME),可通过标准疗法进行治疗。白内障和CME均与该病自然史中的高发生率相关。
考虑到基线特征的关键差异,根据基线视敏度将患者分为“晚期”和“中早”人群。
在晚期患者中,疗效的主要指标是最佳矫正视觉活动(BCVA)。在早期中度患者中,疗效的主要衡量标准是静态视野计测量的视野。单次注射后,QR-421a治疗的患者在晚期和早期中度患者群中,其终点均符合其疾病阶段。
与临床前数据预测一致,Stellar试验3个剂量均有活性。无论患者是纯合子还是杂合子,或是否患有Usher综合征或非综合征性色素性视网膜炎,均未观察到差异。
1、Analysis of advanced patients
最佳矫正视力(BCVA)是对中央视力或视力敏锐度的检查,应用糖尿病视网膜病变早期治疗研究(ETDRS)字母表测量。
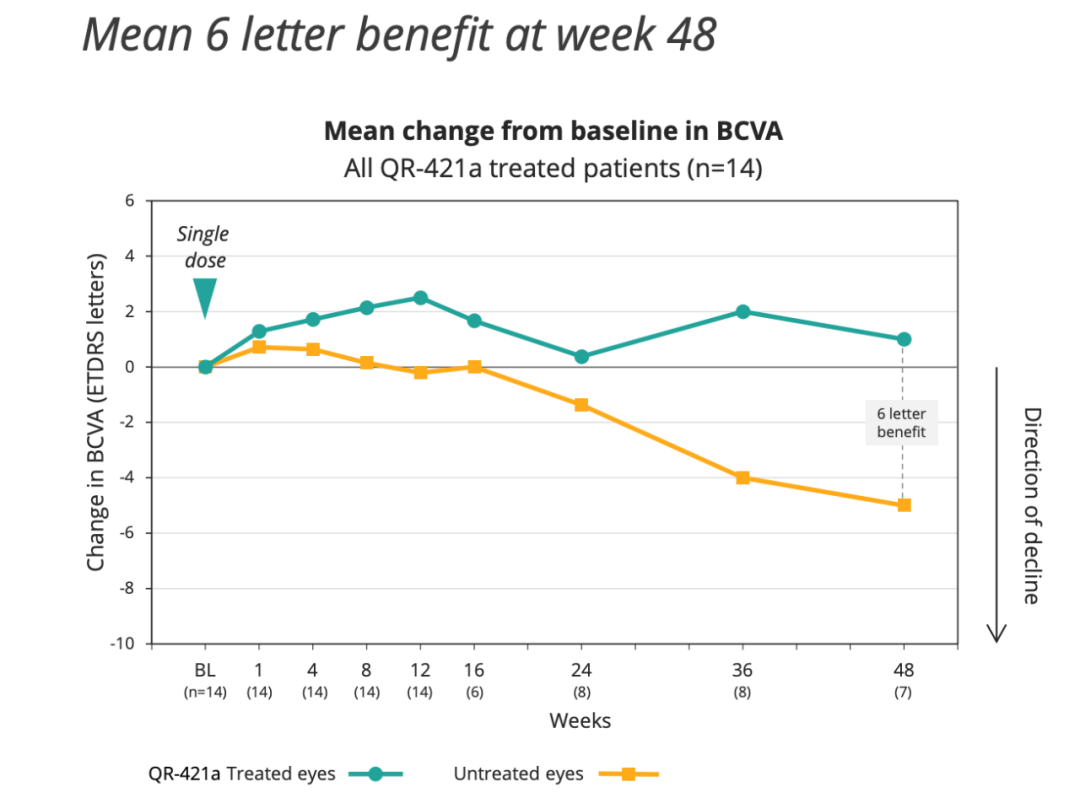
在所有接受治疗的患者(n=14)中,与单次注射后未经治疗(对侧)的眼睛相比,在接受治疗的第48周观察到的平均收益为6.0个字母。
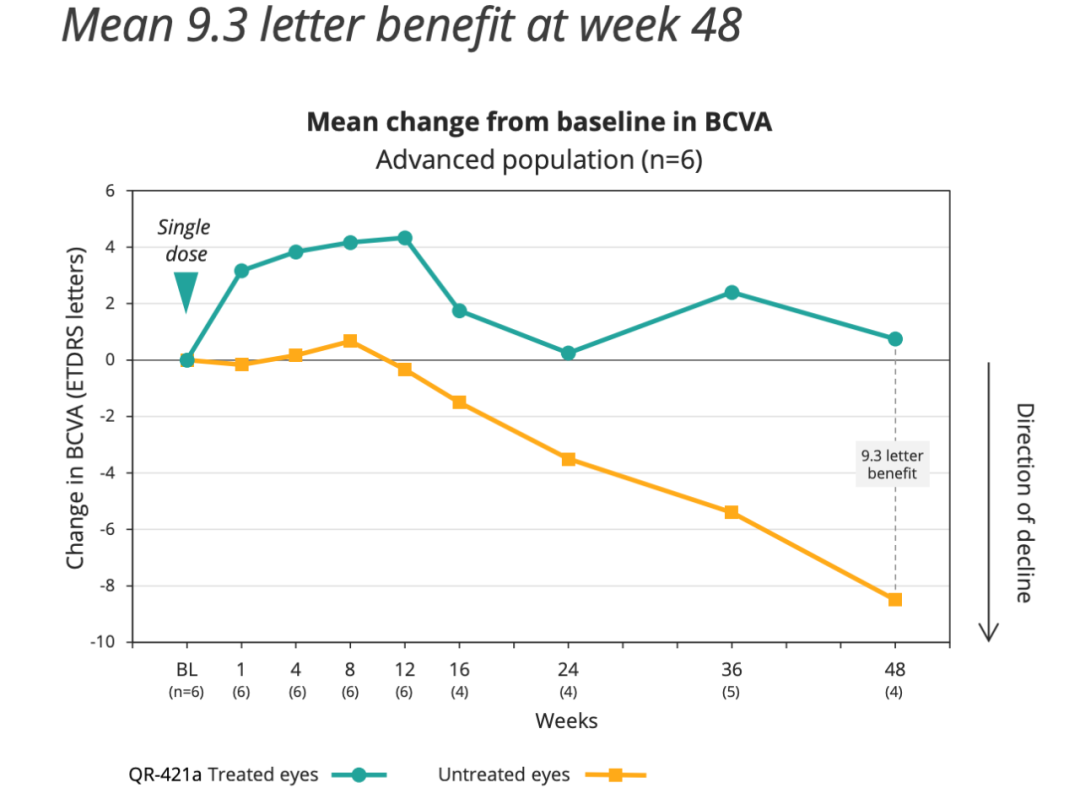
在晚期疾病患者(n=6)中,与未治疗的眼睛相比,治疗的眼睛在第48周的平均获益为9.3个字母,并且该益处维持>12个月。所有6名晚期患者的治疗眼均受益,而假手术组的患者均无治疗眼的受益。
2、Analysis of early-moderate patients
静态视野检查可评估周围视网膜的视野和视网膜敏感性。
在所有接受治疗的患者中,与未经治疗的眼睛相比,经过治疗的眼睛的平均总视网膜敏感性提高了40dB,并且在单次注射后的益处保持> 6个月。
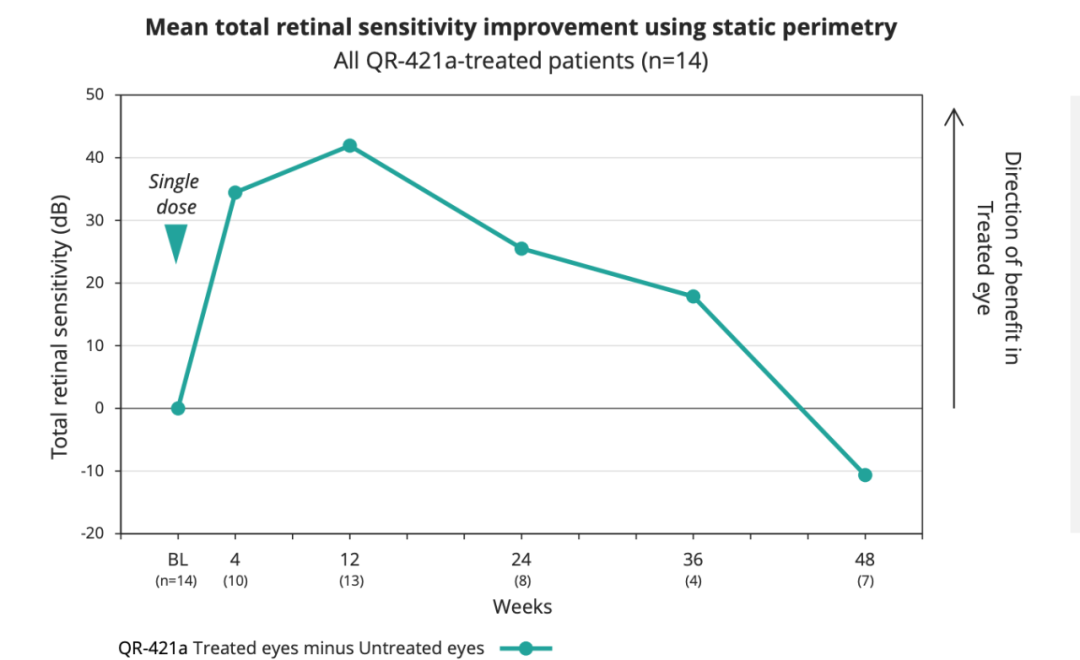
与未经治疗的眼睛相比,经治疗的眼睛平均视网膜基因位点(loci)提高了≥7db,在经过治疗的眼睛中平均有9个基因位点改善了≥7db。
在早期中度患者(n=8)中,在同一时间点,经过处理的眼睛中平均多达13个基因位点改善了≥7db,而未处理的眼睛中有7个基因位点。
在基于OCT的椭球带层评估中注意到了一致的获益,该评估是对感光体生存力以及其他中央视觉功能度量(例如微视野测量)的客观评估。在所有终点上,假手术治疗的眼睛与未治疗的眼睛的反应相似。
基于这些发现,公司计划进行两项关键的2/3期临床试验。根据最初的监管指导,公司计划提交方案以启动这两项2/3期试验。根据试验结果,每个试验都可能作为单独的注册试验提交。与监管机构进行研究设计并最终定稿,这些试验预计将在2021年年底之前开始。这两项试验均有望在全球卓越的临床中心进行。
1、Sirius trial in advanced population
Sirius试验是一项2/3期研究,将针对基线BCVA≤20/40的晚期患者。Sirius的初步设计是一项双盲、随机、假对照、24个月、多剂量研究。预计该试验将招募约100名由于USH2A外显子13突变,患有Usher综合征和nsRP的成人,包括纯合子和杂合子。该试验的主要终点为18个月时的BCVA,有可能进行较早的中期分析。在这个三臂研究中,两臂每6个月施用两次的不同剂量,第三臂接受假治疗。
2、Celeste trial in early-moderate population
与Sirius平行,公司计划在中度早期患者中开始“Celeste” 2/3期临床试验。Celeste的初步设计是一项双双吗,随机,假对照,24个月多剂量研究。预计该试验将招募约100名由于USH2A外显子13突变,患有Usher综合征和nsRP的成人。该试验的主要终点将基于18个月的静态视野检查,并有可能进行较早的中期分析。在此三臂研究中,将研究每6个月施用两次的不同剂量,第三臂将接受假治疗。
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com



 药选址
药选址

