11 月 17 日,恒瑞医药宣布,公司自主研发的 1 类新药 SHR6390 获批临床,即将开展联合内分泌治疗在 HR 阳性、HER2 阴性女性乳腺癌的辅助治疗的国际多中心、随机、双盲的 Ⅲ 期临床试验。

SHR6390 是恒瑞开发的一款高效、选择性小分子 CDK4/6 激酶抑制剂,通过使 CDK4/6 与 Cyclin D 组成的复合物不能磷酸化下游 Rb 蛋白,阻止细胞由 G1 期进入 S 期,从而发挥抑制细胞增殖和抗肿瘤的作用。根据 Insight 数据库,该药目前已有 18 条获批的临床受理号,最早于 2015 年 9 月获批临床。截至当前,恒瑞已针对该药启动了 10 项临床试验,包括 2 项 III 期临床,详情如下:
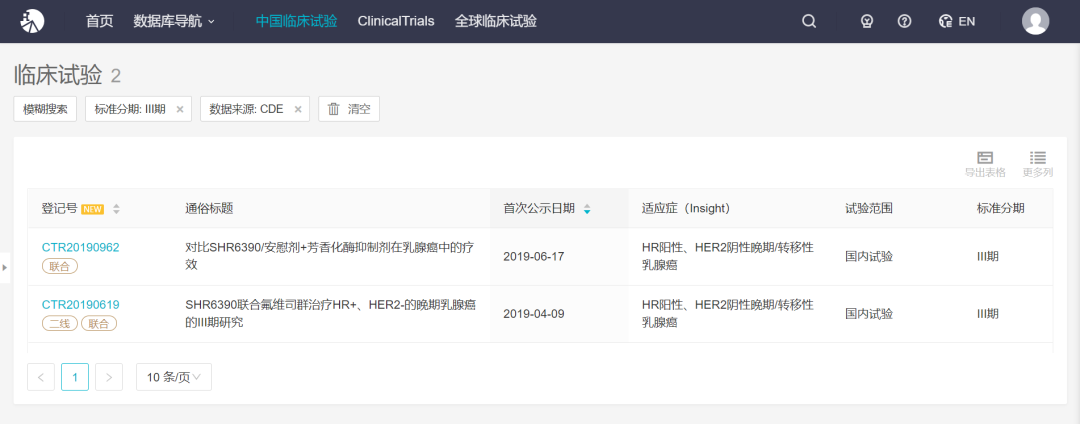
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
不过,此前该药开展的临床试验均为国内试验,此次获批的临床为国际多中心临床试验。
目前,在全球范围内,已有三款 CDK4/6 抑制剂获批,分别为辉瑞的 palbociclib(哌柏西利)、诺华的 Ribociclib 和礼来的 Abemaciclib。然而,除了辉瑞哌柏西利之外,尚未有其他 CDK4/6 抑制剂在国内获批,仅礼来 Abemaciclib 片已于 2019 年 11 月报产。
辉瑞的哌柏西利为全球首个上市的 CDK4/6 抑制剂,其商品名 Ibrance,于 2015 年 2 月通过加快审评途径获美国 FDA 批准上市,用于与来曲唑联合作为初始内分泌疗法治疗HR+/HER2- 的晚期乳腺癌,并于 2016 年 2 月获批新适应症。目前,Ibrance 已在欧盟、日本等多个国家和地区上市。
2018 年 7 月,哌柏西利首次在中国获批,商品名为爱博新,用于联用芳香化酶抑制剂作为初始内分泌疗法治疗 HR+/HER2-局部晚期或转移性乳腺癌。当前,除了原研辉瑞外,已有 19 家企业布局其仿制药,其中先声药业和齐鲁制药已报产,奥赛康、豪森、科伦、正大天晴等 6 家企业正在 BE 试验阶段,另有 11 家企业获批临床。
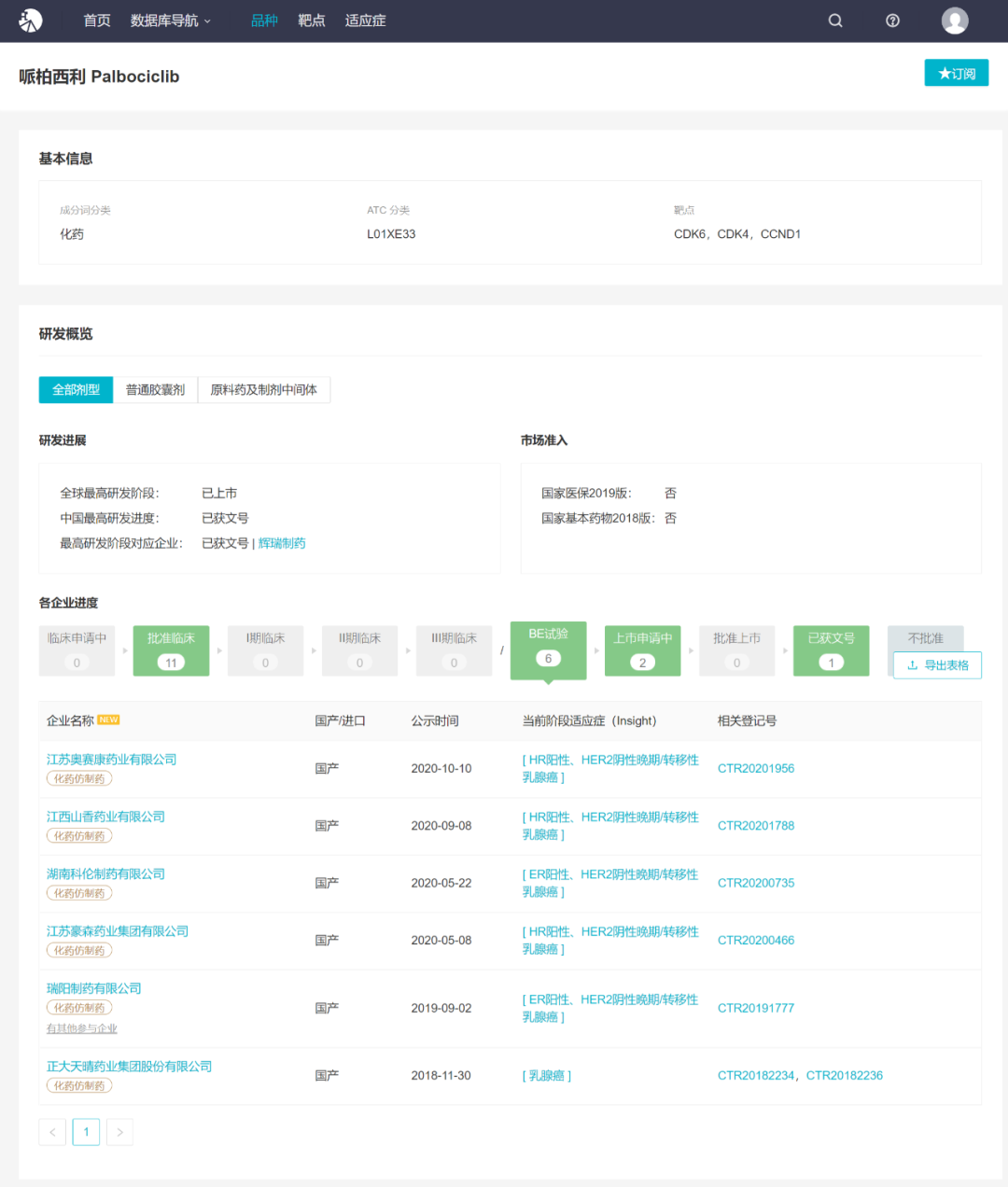
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
另外,在国内同靶点新药已有 11 家处于临床阶段,涉及复星医药、豪森、正大天晴等,不过恒瑞进度最快,已进展到 III 期。
公开数据显示,同类产品 2019 年全球销售额约为 60.21 亿美元。截至目前,SHR6390 累计已投入研发费用约 17,494 万元人民币。

点击阅读原文
试用 Insight 数据库 30 天




 个人中心
个人中心
 我是园区
我是园区




