自2019年,国务院发布《中华人民共和国人类遗传资源管理条例》之后,关于条例细则出台,加速遗传办“精简程序、审批提速”的呼声日益提高。
3月22日,科技部终于发布了《人类遗传资源管理条例实施细则(征求意见稿)》(以下简称“征求意见稿”)公开征求意见的通知。
可喜的是,条例细则终于对企业的主体资格认定和国际备案合作进行了明确。
“业界确实是等了好久。”海问律师事务所上海和北京办公室生命科学业务与医药健康领域合伙人吴婷表示,征求意见稿中对于外方主体认定、临床试验机构备案的适用条件、信息对外提供安全审查、国际合作的备案和审批的优化流程、行政执法等方面的实施细则备受业内关注。
在外方主体资格认定方面,管理条例中明确规定:“境外组织、个人及其设立或者实际控制的机构(以下称“外方单位”)不得在我国境内采集、保藏我国人类遗传资源,不得向境外提供我国人类遗传资源。”
其中,“外方单位”指的是 “境外组织及境外组织、个人设立或者实际控制的机构。”
但吴婷指出,如何界定“实际控制”成为许多企业的痛点,增加了企业与监管部门的沟通成本。本次的征求意见稿就“实际控制”列出了四种情形:
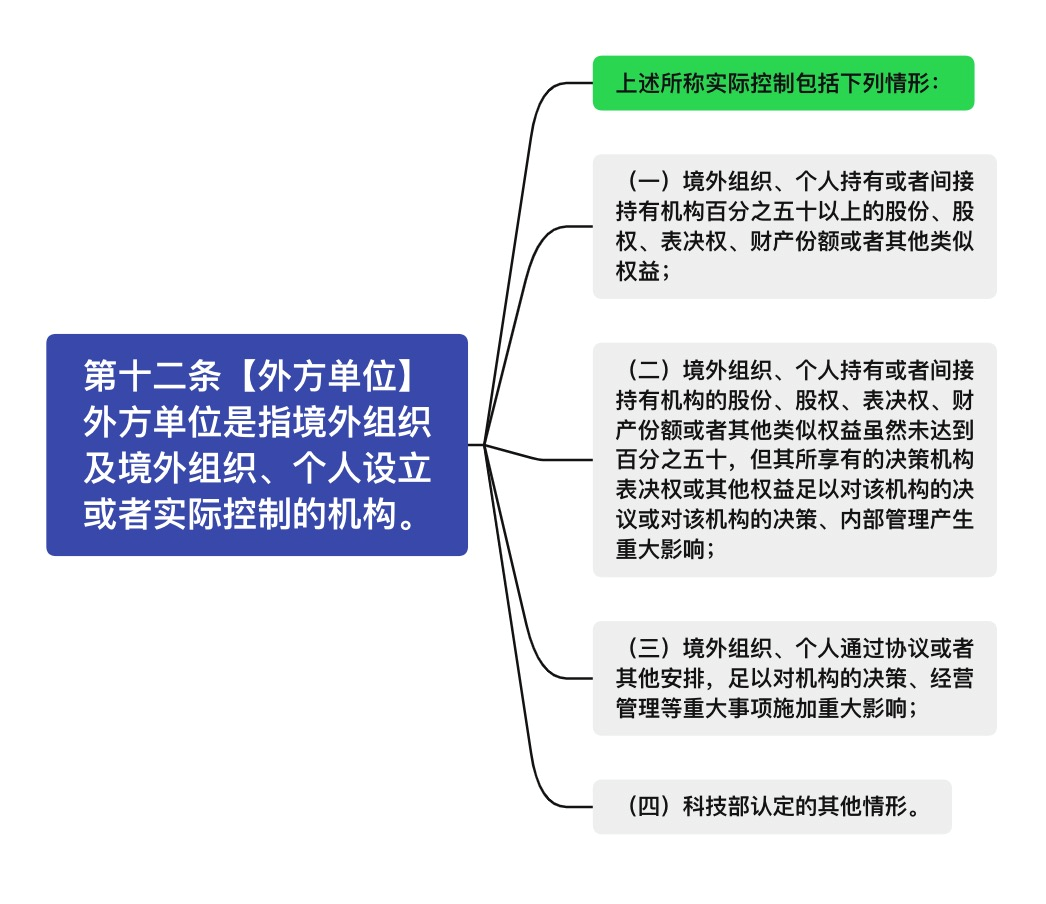
这一认定细则主要限制了持股超过50%,以及持股未达50%但拥有决策权的境外主体在我国进行人类遗传资源的相关活动。值得注意的是,吴婷解读,据此规定,协议控制(即“VIE”)架构模式的企业被视为“外方单位”。
在国际合作备案方面,吴婷认为,相较于之前的规定,征求意见稿就备案适用条件有所放宽。
譬如此前要求人类遗传资源的样本检测必须由中方医院或中方医院委托的机构完成,“这一点要求比较严格,导致了很多的临床试验满足不了备案的要求,因为很多的临床试验样本检测(比如基因测序)医院可能没有能力、资源和设施自行完成,有些医院也没有时间和精力去委托和管理第三方实验室,实践中通常需要企业委托和管理第三方实验室,这就导致许多企业无法满足备案的要求,从而延长了临床审批的时间。”
但征求意见稿对不需要审批的备案条件作出详细规定,主要分为两种情况:
情形一指的是,所涉及的人类遗传资源采集、检测、分析和剩余样本处理等在临床机构内进行的;
这一情况主要是传统意义的临床机构,指在相关部门备案,可以开展临床研究的医疗机构、疾病预防控制机构等。
情形二指的是,所涉及的人类遗传资源在临床机构内采集,并由相关药品和医疗器械上市许可临床试验的临床试验方案指定的境内单位进行检测、分析和剩余样本处理的。
第二种情况意思是样本采集需在临床机构内进行,检测、分析和剩余样本处理可以在“指定境内单位”进行,比如在申办方委托的第三方机构。吴婷介绍,相较于传统的国际合作行政审批程序,国际合作备案程序下相关申请的通过率相对较高,且备案所需时间较短且更具有可预期性。备案程序所需时间通常在1.5月至2个月左右,而国际合作行政审批流程通过率相对较低,且审批所需时间理想条件下也需要至少2个月左右,特殊情况下某些申请可能搁置半年到一年。
征求意见稿下,企业更多的临床试验可适用时间更短且预期性更高的备案简化流程,这也更有利于国内企业开展全球同步研发,尽早加入全球多中心临床试验中。
但是对于此次征求意见稿的发布,某生物制药企业负责人表示,在实践中,国内许多创新生物医药企业都采用协议控制(即“VIE”)的架构模式,其主要目的在于海外融资。
而若将具有VIE架构企业列为“外方单位”将使得这些创新药企业的研发、临床面临挑战,而拆解VIE架构又使得这些企业无法继续进行海外融资。
从第11条和第33条、第36条联动看,只有中方单位可以开展我国人类遗传资源采集、保藏和对外传输。而根据第12条现在的措辞,VIE架构的企业会被认定为外方单位。并且第39条中,显示的国际合作的主体,亦限定在中方单位。
针对此次细则的第二十三条【沟通交流】
,“采集、保藏、利用和对外提供我国人类遗传资源的单位在行政审批申请前、开展相关获批事项活动过程中以及相关信息备份备案等阶段,可以就重大问题与生物中心进行沟通交流。生物中心可以根据工作需要组织与申请人进行沟通”,
上述负责人建议,
要展开介绍沟通交流申请的具体步骤程序,需要提供的支持性材料,并规定中心给与应答反馈的时限,以方便企业在遇到重大问题时可以利用该途径与生物中心进行沟通,具有操作性。
而针对第六十四条【备案申报】为获得相关药品和医疗器械在我国上市目的的临床研究行政备案应在获得药品监督管理部门临床试验批件或备案后,即可进行备案。企业建议,
应设定回复时间限制,并且如果备案不予通过,应写明详细不予通过的理由,并与申请人沟通,以指导申请人更快更高效和顺利的进行相关的备案申请。
针对细则,也有生物制药企业建议优化咨询电话系统,实现企业可在系统中在线提交咨询内容,以便更高效的沟通交流。或者是由于目前实践中,由于科技部的资源有限,存在无法及时沟通、答复的情况,建议将审批权能进一步下放至省/直辖市一级。
也有企业建议
在自体CAR-T细胞在制备过程中,产生的工艺参数为生产技术相关,不涉及人类基因组信息,企业在对外提供时,可以不进行备案。
另外,根据现有第41条的措辞,由研究者发起的临床试验(“IIT”)在现实实践中是无法进行人遗审批的。建议实施细则能将IIT明确纳入受理范围。
吴婷认为,细则的发布对于行业呼声甚高的问题进行了回应,但是仍有一些细节尚待完
善。
例如对于人类遗传资源信息的范围定义仍有待进一步澄清,比如是否限于基因或基因组数据,还是根据目前科技部服务指南的解读包括除基因数据之外的多种数据类型。
实践中,各类信息类型多种多样,哪些信息需要备案、哪些不需要备案并未得以明确,也是企业的痛点,企业通常只能根据每个具体情况分别评估,还没有普适性的标准可以参考,这也是不少企业关心的内容。

毋庸置疑,我国的人遗资源管理正在不断完善的过程中。
2019年国务院发布《中华人民共和国人类遗传资源管理条例》,
意味着从行政法规层面次加强和明确了对中国作为多民族人口大国的人类遗传资源有效保护和合理利用的宗旨。
人类遗传资源管理的目的是为了有效保护和合理利用我国人类遗传资源,维护公众健康、国家安全和社会公共利益。
2020年10月17日,十三届全国人大常委会第二十二次会议表决通过了《中华人民共和国生物安全法》(简称《生物安全法》)。这部法律自2021年4月15日起施行。《生物安全法》共计十章八十八条,聚焦生物安全领域主要风险,完善生物安全风险防控体制机制,着力提高国家生物安全治理能力。
该法明确国家加强对我国人类遗传资源和生物资源采集、保藏、利用、对外提供等活动的管理和监督,国家对我国人类遗传资源和生物资源享有主权。
这是自2019年《人类遗传资源管理条例》正式施行以后,再次对人类遗传资源管理的备案制进行了明晰。
但是随着中国创新药的蓬勃发展,业内呼吁明确人遗资源实施细则,提高创新药神评审批效率的呼声日益提高。
3月4日,科技部人遗办针对申请人在人遗资源行政审批和备案中常见的采集审批、保藏审批、国际合作科学研究审批、国际合作临床试验备案、信息对外提供或开放使用备案五个方面多个问题进行了解答。
3月22日,细则征求意见稿的发布,为产业提振了信心。不过吴婷提醒企业,此次细则中对于行政处罚有了更加明晰的要求。此前无论是国内生物制药企业、CRO企业、研究机构、还有跨国药企均在人遗资源方面受到过相关的行政处罚,虽然仍是少数,
随着细则对执法程序的明确,或许相关执法会越来越成为新常态,也要求企业提高人遗资源合规方面的重视。
3月29日20:00,吴婷律师将在微解药APP《药事每周谈》栏目详细解读《人类遗传资源管理条例实施细则(征求意见稿)》,介绍和梳理征求意见稿的新变化和亮点,起草背景以及其所反映的监管趋势,以及对生物医药公司各类业务活动特别是研发活动的可能影响。敬请关注!
![]()
![]()
![]()




 个人中心
个人中心
 我是园区
我是园区





