作者:医药笔记
近日,Apellis宣布靶向补体C3药物Empaveli(Pegcetacoplan,APL-2)用于玻璃体腔注射治疗年龄相关性黄斑变性继发地图样萎缩的适应症已经获得美国FDA受理并被纳入优先审评,PDUFA日期为2022年11月26日。FDA表示目前没有计划召开咨询委员会议讨论这一上市申请。消息一出,Apellis股价一度上涨超过27%。
补体系统和靶向补体的药物研发
补体系统与靶向补体的药物研发并不是一个全新的概念,自1888年George Nuttall发现羊血清对炭疽杆菌具有温和的杀灭作用以来,人们对于补体的研究持续深入。
补体系统(Complement System)是人体免疫系统的一部分,是先天免疫系统和适应性免疫系统的重要组成部分,可以增强(补充)抗体和噬菌体细胞清除病原体和受损细胞,促进炎症攻击病原体细胞膜,介导免疫溶菌或溶血等作用。补体系统由多种血清和膜蛋白组成,该系统主要由肝脏合成的多种蛋白质组成,并作为非活性前体在血液中循环,涉及大约30多种蛋白质和蛋白质片段,约占血清中球蛋白的10%。
整套系统因其高度复杂的运作机制也被描述为补体级联反应(Complement Cascade)。当人体面对微生物感染或受损细胞威胁时,补体系统被激活,补体系统中的蛋白酶会对特定蛋白质进行裂解,释放细胞因子,启动进一步裂解的放大级联反应。
该过程可由三条生化途径激活:分别为经典途径(Classical pathway),旁路途径(Alternative pathway)和凝集素途径(Lectin pathway),三条途径在下游汇合于C3,并通过C5最终活化产生攻膜复合物(MAC),参与免疫,是人体重要的天然免疫屏障。
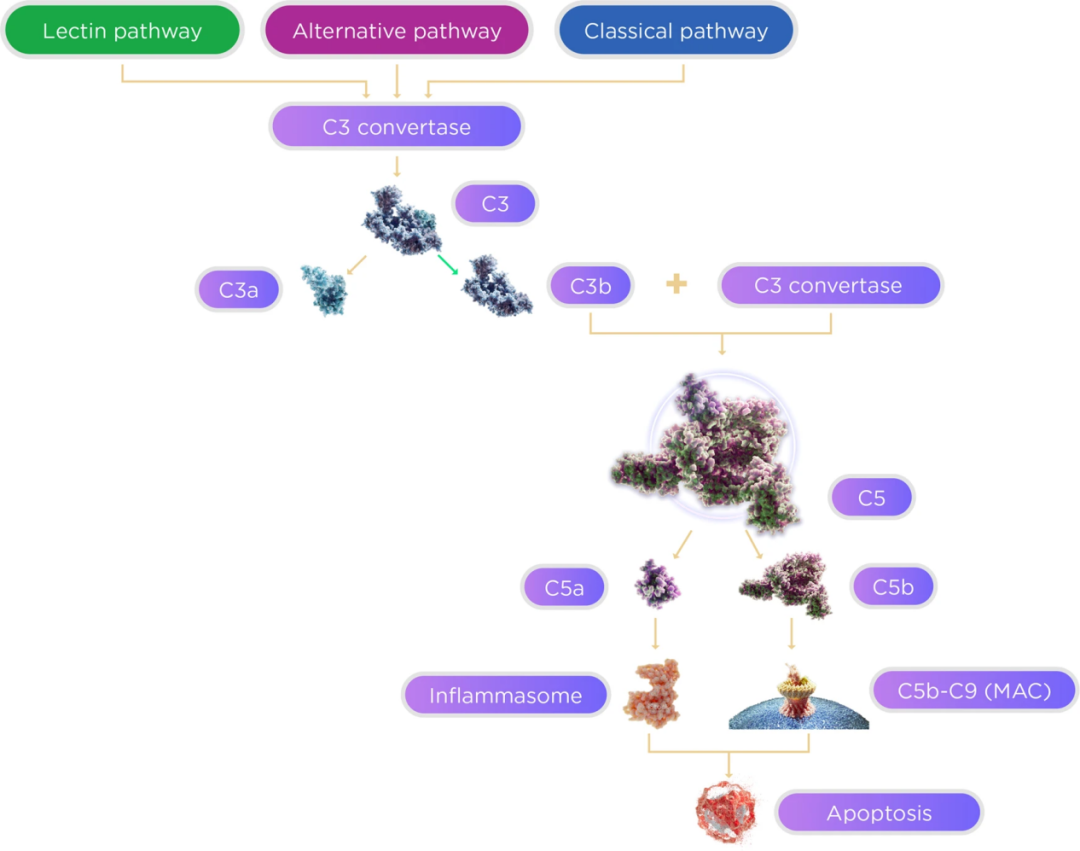
补体级联反应示意图源:Eye
(DOI:https://doi.org/10.1038/s41433-021-01765-x)
作为人体免疫系统的一部分,正常的补体系统能发挥积极的保护作用。然而,当补体系统过度激活或抑制时,则可能会产生严重的负面效果。已有的研究发现,在多种疾病的发病机制中,补体系统均扮演了重要角色。其影响范围之广,涵盖了从眼部疾病,牙周疾病等急性炎症,到癌症,自体免疫疾病,神经退行性疾病,肾脏疾病和慢性溶血性疾病等慢性病。
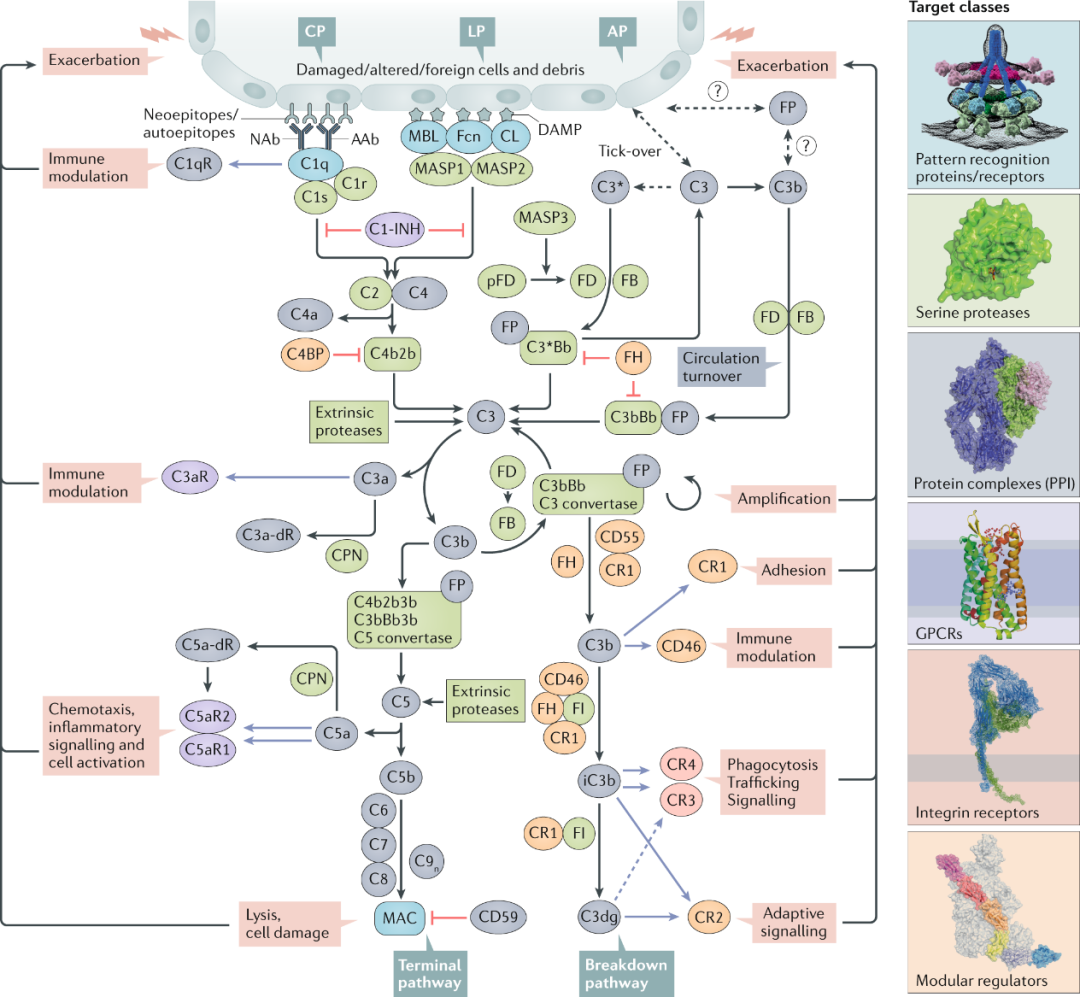
补体级联反应的疾病相关效应功能和药物靶点简图
靶向补体药物在眼科领域中的开发和应用
在眼科这个细分的赛道,自anti-VEGF抗体/抗体片段或受体融合蛋白在临床上得到广泛应用后,wet AMD/湿性黄斑病变的治疗获得了长足的进步,成功开发了数个重磅新药:Regeneron/再生元的Aflibercept/EYLEA (2021年销售额92.4亿美金),Roche/罗氏的Ranibizumab/Lucentis(2021年销售额36.5亿美金)和康弘药业的Conbercept/朗沐(2021年销售额13.2亿人民币)等。EYLEA上市后,帮助再生元一举奠定了眼科领域的龙头地位。
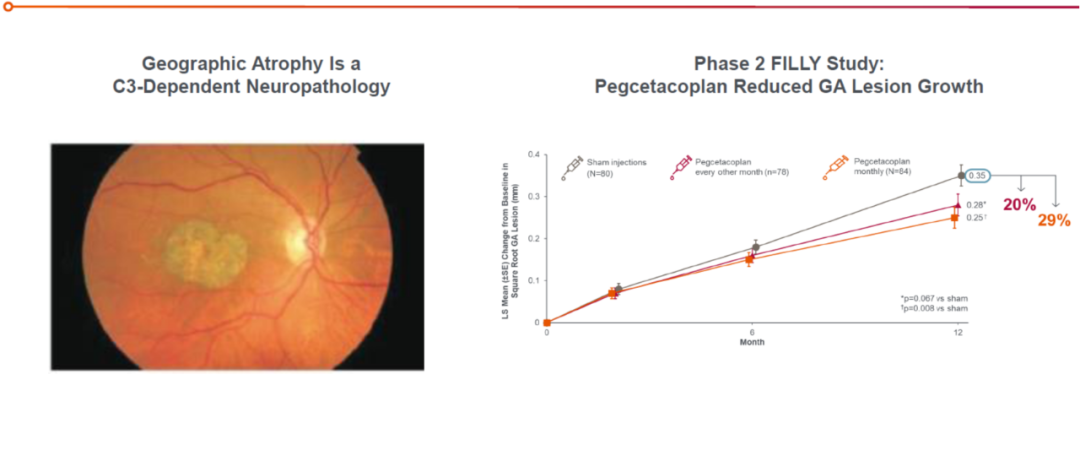
从流行病学数据方面分析,干性黄斑病变/dry AMD(地图样萎缩)的患者人群比湿性黄斑病变/wet AMD更加庞大,但尚未有一款药物成功上市。目前的相关研究均显示干性黄斑病变/地图样萎缩是由于补体系统失调所导致的C3 依赖性的眼科疾病。
单独靶向C5未能在临床上显示出有统计学意义的治疗效果,而首款靶向C3补体特异性药物——Empaveli(Pegcetacoplan,APL-2),在干性黄斑病变/地图样萎缩的 II 期临床中,获得迄今为止最令人兴奋的数据。
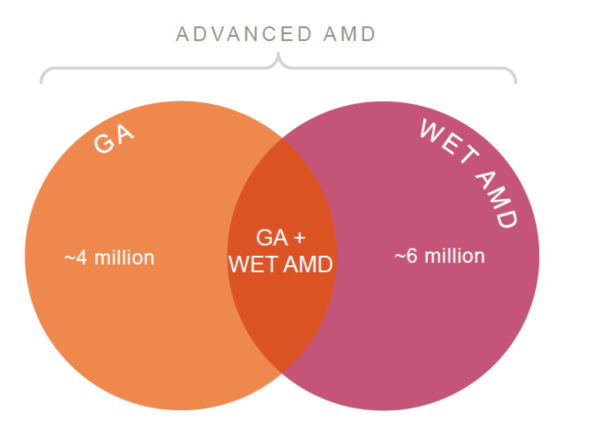
在干性和湿性黄斑病变的患者,其中有一部分的患者是重叠的:既有干性黄斑病变又有湿性黄斑病变(GA+wet AMD)。同时,根据临床调研结果,很多患者对于在眼球内注射存有心理障碍,而多次频繁注射确实会增加并发症的发生风险。
对于这部分患者来说,单独靶向anti-VEGF的治疗存在至少2个未满足的临床需求:①更长给药间隔/给药便捷性的提高,②同时靶向双靶点所带来的药效的提升:如靶向VEGF/补体(CR1)的IBI302(信达生物),和靶向VEGF/Ang-2 双靶点的Faricimab (VABYSMO)。
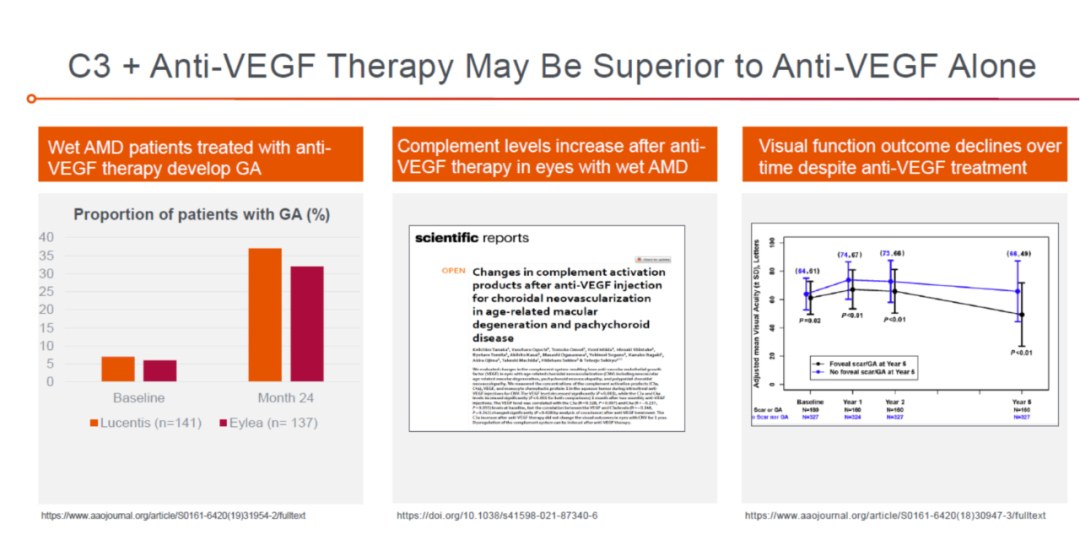
研究显示,长期接受anti-VEGF药物治疗的患者存在疗效不佳或耐受情况,在部分患者中会进展出现黄斑萎缩或纤维化。在临床试验中发现,大约30%~35%的湿性黄斑病变的患者在接受了24个月的anti-VEGF的治疗后会发展成为干性黄斑病变(地图样萎缩),即变成GA + wet AMD。这一未满足的临床需求可为这个百亿美金的赛道带来新的治疗方向。信达生物的IBI302 anti-VEGF/CR1 融合蛋白已进入临床 II 期;Apellis 公司为此特异开发了新一代C3抑制剂,并具有:分子量小,PK长,制剂浓度高等特点,APL-2006为Apellis公司专门针对此细分赛道开发的特有的C3抑制剂与anti-VEGF的融合蛋白,计划于2023 上半年进行IND申报。
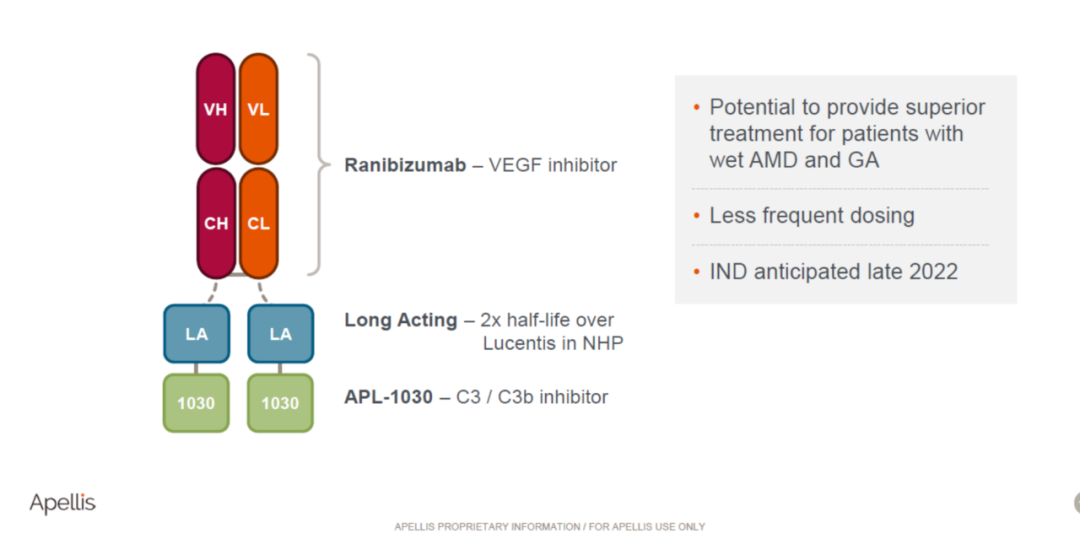
Apellis APL-2006结构示意图(公开资料)
我国眼科市场自2014 年以来保持双位数高速增长态势,到2021年其整体规模已达2100亿元。今年初,兼具“规模”与“增速”的眼科赛道又再获政策机遇:《“十四五”全国眼健康规划(2021—2025年)》将眼底疾病首次上升为国家战略。在这样的背景下,眼科赛道或许又将迎来新一波热度,未来眼科赛道的竞争将越来越激烈。参与此赛道的竞争者应关注的差异化在于:更便捷的给药方式(更高浓度制剂带来的更长PK;或类PDS给药装置),或者是同时靶向补体与VEGF的双靶点所针对的未满足的临床需求(35%的接受单一anti-VEGF治疗的患者会产生地图样萎缩)。差异化的靶点设计和更好的成药性才能带来在这个领域中的竞争优势,并转化成临床优势和商业优势。
声明:本稿件为转载,仅用于分享,不代表本公众号立场,如涉及版权等问题,请尽快联系我们,我们将第一时间更正或删除,谢谢
本文仅为作者观点,不构成任何投资建议

往期回顾
|
1 |
|
|
2 |
|
|
3 |
|



 个人中心
个人中心
 我是园区
我是园区