▎药明康德内容团队报道
今日,中国国家药监局药品审评中心(CDE)网站公示信息显示,石药集团中诺药业递交的“盐酸米托蒽醌脂质体注射液”上市申请拟被纳入优先审评,理由是“符合附条件批准的药品”。该药本次申请的适应症为复发或难治的外周T细胞淋巴瘤(PTCL)患者。

截图来源:CDE官网
盐酸米托蒽醌脂质体是石药集团自主开发的米托蒽醌脂质体制剂
,属2.2类改良型新药,石药集团具有完全知识产权。2017年,美国FDA曾授予该药孤儿药资格,用于治疗外周T细胞淋巴瘤。
根据石药集团公告,米托蒽醌是临床上应用较广的广谱抗肿瘤药物,由于其严重的心脏毒性及骨髓抑制等不良反应,该药的临床应用受到严重的限制。将米托蒽醌制成脂质体制剂后,该药的药代、组织分布、药效及毒性产生了显著的变化,与普通制剂相比,疗效及安全性显著增加。

该药本次在中国的新药上市申请主要基于一项单臂、开放、多中心的2期研究结果,该研究旨在评估盐酸米托蒽醌脂质体注射液治疗复发/难治的外周T细胞和NK/T细胞淋巴瘤的效果。本次申请上市的适应症为——适用于既往至少经过一线标准治疗的复发或难治的外周T细胞淋巴瘤患者。
中国药物临床试验登记与信息公示平台信息显示,除了外周T细胞淋巴瘤外,石药集团还登记了多项关于盐酸米托蒽醌脂质体注射液的临床试验,涵盖的适应症包括结外鼻型NK/T细胞淋巴瘤、二线治疗小细胞肺癌、晚期复发或转移性乳腺癌、晚期肝细胞癌等多种癌症。
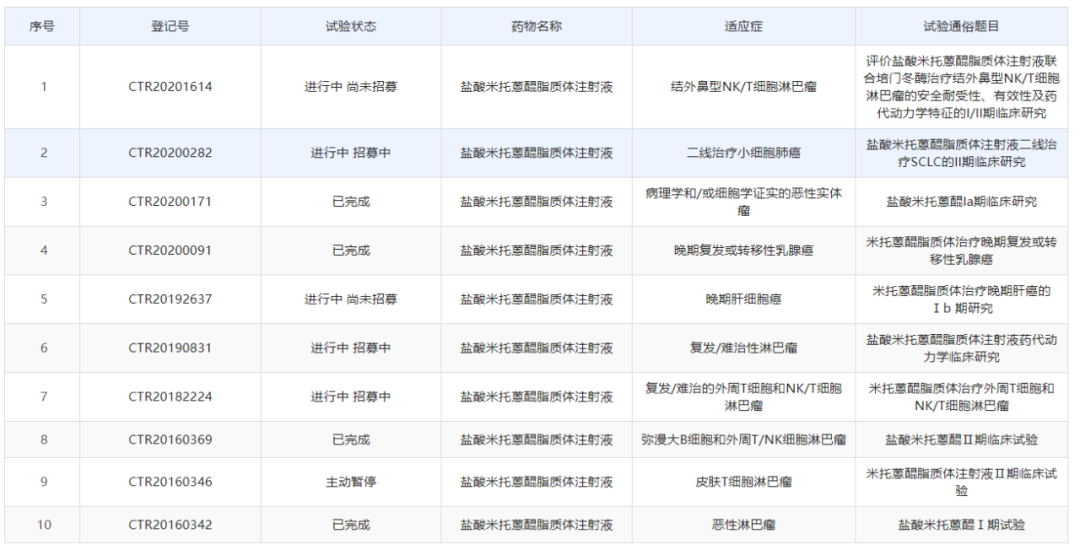
截图来源:中国药物临床试验登记与信息公示平台
祝贺石药集团盐酸米托蒽醌脂质体注射液上市申请拟被纳入优先审评,希望该药早日获批,为患者提供新的治疗选择。
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注“
医药观澜
”微信公众号,了解更多中国医药创新动态。

注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]
中国国家药监局药品审评中心(CDE)
. Retrieved Sep 07,2020, from
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20
[2]石药集团「盐酸米托蒽醌脂质体注射液」新药上市申请获得受理. Retrieved Aug 25, 2020, from https://pdf.dfcfw.com/pdf/H2_AN202008251401385960_1.pdf
[3]石药集团治疗恶性肿瘤药物「盐酸米托 醌脂质体」 获美国药监局颁发孤儿药资格确认. Retrieved Sep 27, 2019, From http://data.eastmoney.com/notices/detail/01093/AN201709270915202244.html









 个人中心
个人中心
 我是园区
我是园区




