▎药明康德内容团队报道
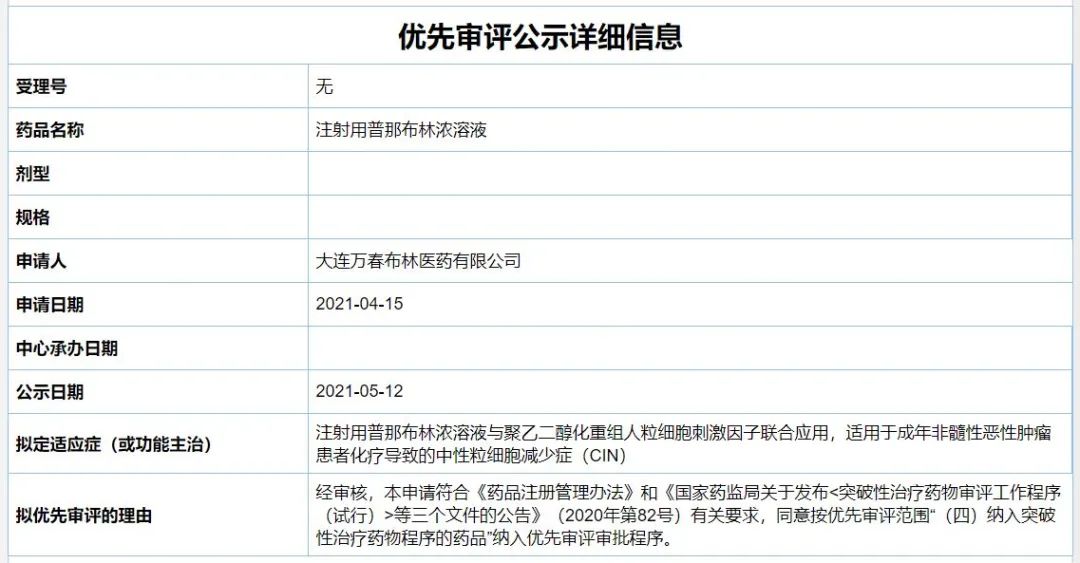
5月12日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)最新公示,万春医药的注射用普那布林浓溶液已被纳入拟优先审评公示名单,针对的适应症为——成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症(CIN)。公开资料显示,普那布林是一种“first-in-class”鸟嘌呤核苷酸交换因子(GEF-H1)激活剂,是万春医药成立以来首个递交新药上市申请(NDA)的创新药。

普那布林是万春医药成立后的首款在研产品,也是其核心产品。作为一种鸟嘌呤核苷酸交换因子激活剂,普那布林可通过逆转由化疗药物诱导的骨髓中嗜中性粒细胞的阻断形成,维持中性粒细胞水平在正常范围内,达到早期保护骨髓中白细胞的作用,以一个不同于G-CSF(粒细胞集落刺激因子)的作用机制来减少早期中性粒细胞减少症的发生。
2020年9月,中国NMPA和美国FDA已分别授予普那布林在CIN治疗领域的“突破性治疗品种”和“突破性疗法认定”。今年3月,万春医药宣布向FDA和NMPA分别提交了普那布林的NDA。
根据拟优先审评公示信息,普那布林浓溶液本次在中国申请的适应症为:
与聚乙二醇化重组人粒细胞刺激因子联合应用,适用于成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症
。
根据万春医药在2020年11月发布的新闻稿,在一项普那布林与培非格司亭联合治疗乳腺癌的国际多中心3期研究PROTECTIVE-2中,普那布林达到了主要终点和所有次要终点。ROTECTIVE-2
,普那布林+培非格司联合用药对第一周期4级中性粒细胞减少症的预防率提高超过100%:联合治疗组中未发生4级中性粒细胞减少症的患者百分比为31.5%,远高于培非格司亭单药组的13.6%。根据万春医药之前发布的新闻稿,这是CIN领域30多年以来在治疗标准和临床获益上的首次重大突破。
此外,ROTECTIVE-2的
还显示,对于严重中性粒细胞减少症的预防,普那布林与培非格司亭联合治疗优效于培非格司亭单药标准治疗:与单独使用培非格司相比,联合用药可降低50%以上的严重中性粒细胞症的发生率,并减少40%以上的发热性中性粒细胞减少症(FN)风险。
除了CIN治疗领域,万春医药也在探索普那布林在非小细胞肺癌(NSCLC)领域的治疗效果。在2期临床试验中,普那布林(+多西他赛)已显示出了抗癌活性。目前,万春医药正在开展一项名为DUBLIN-3(103研究)的3期临床试验,评估普那布林治疗EGFR野生型NSCLC患者的疗效。
值得一提的是,万春医药首席执行官黄岚博士此前在接受药明康德内容团队
时曾表示,普那布林与经典的放(化)疗和抗PD-1/PD-L1/CTLA-4抗体等联用,还有望成为肿瘤免疫治疗的骨架药物。在抗PD-1抗体无响应的肿瘤模型中,普那布林+抗PD-1抗体+放疗已展现出了良好的抗肿瘤响应。万春医药也将探索普那布林在其它实体瘤中的治疗潜力。
祝贺万春医药普那布林取得的一系列研究进展,期待这款创新药早日获批,为广大患者带来新的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
[1]中国国家药监局药品审评中心. Retrieved May 12 2021, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25#
[2]万春医药向FDA、NMPA提交首个原创新药普那布林上市申请.Retrieved Mar 31 2021, from https://mp.weixin.qq.com/s/y-376llXwZngr_yUYfHkNw
[3]万春医药官网信息及公开资料.
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。








 个人中心
个人中心
 我是园区
我是园区




