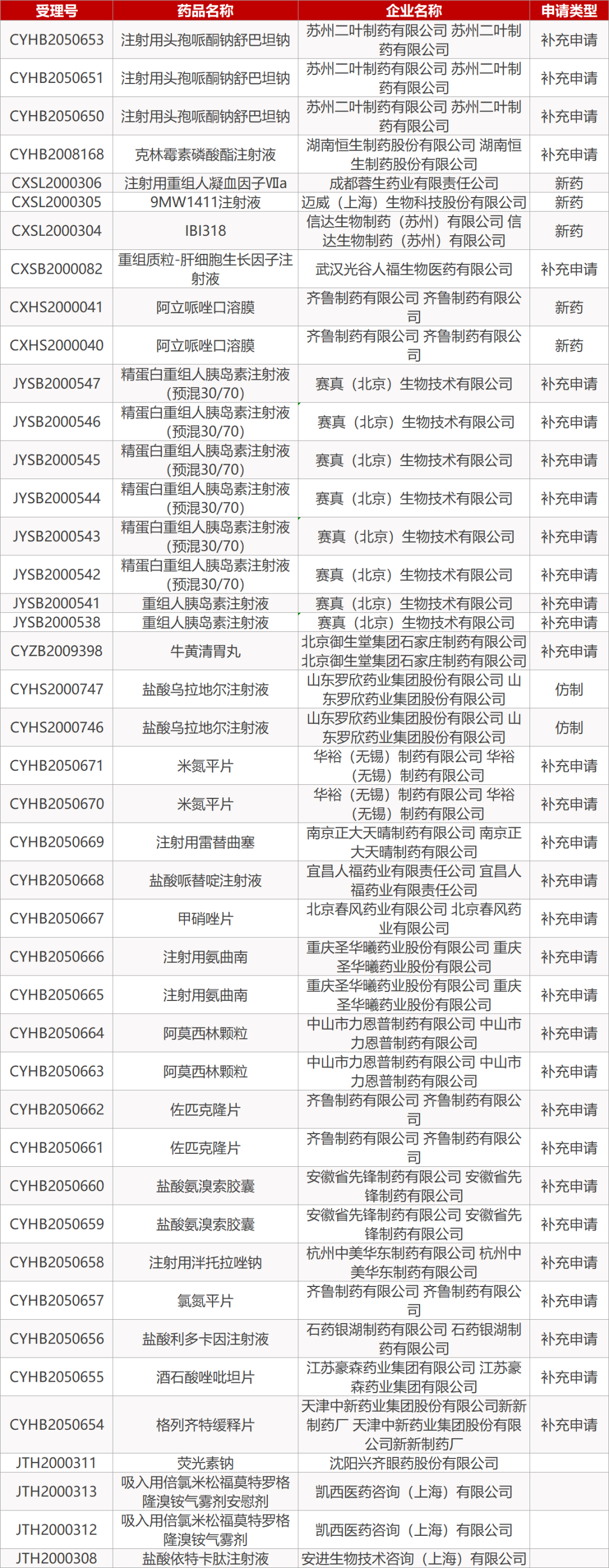
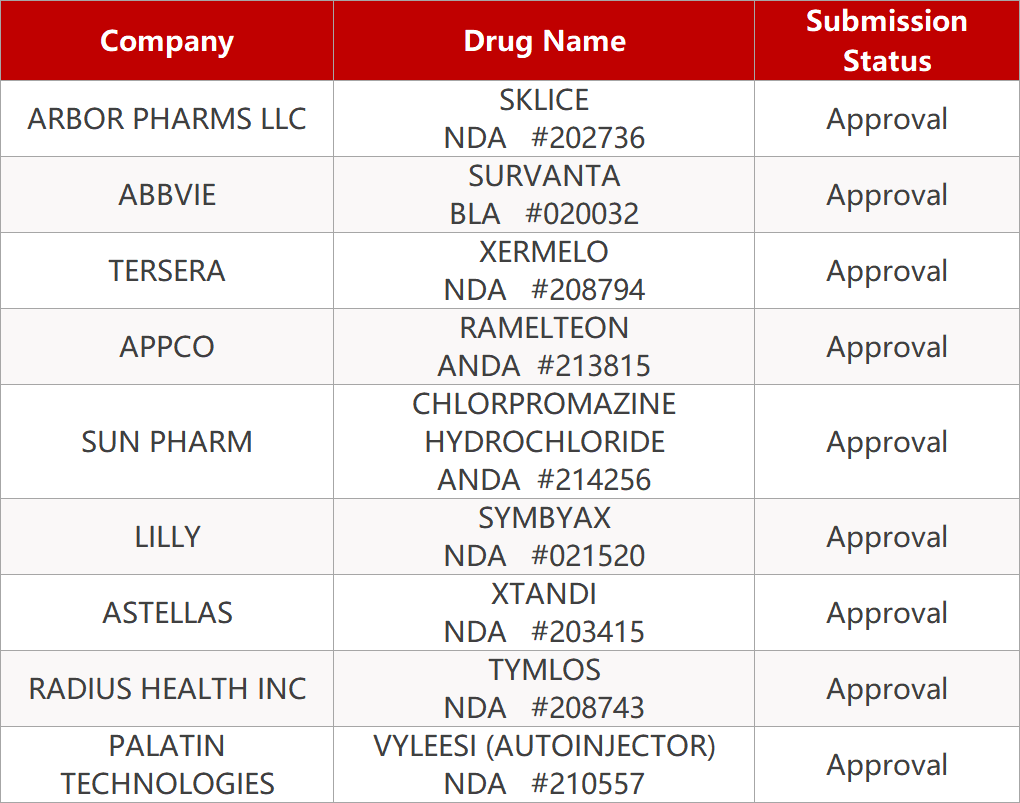
「 本文共:15条资讯,阅读时长约:3分钟 」




1.药品审评审批16项信息或将公开。10月27日,CDE发布《药品审评审批信息公开管理办法(征求意见稿)》,共计7章25条。分别规定了制定目的和依据,信息公开的适用范围、定义、原则,药审中心职责,以及药审中心和申请人的基本要求等;规定了受理信息、审评审批过程信息、审评审批结果信息和其他审评审批信息的公开内容要求和程序;规定了信息公开工作接受社会监督,药审中心设置专栏收集业界意见,建立相应工作机制和工作流程,完善信息公开工作。
2.罗氏Tecentriq即将在华获批第2项适应症。罗氏阿替利珠单抗(Tecentriq)在中国提交的第2项适应症上市申请进入“在审批”阶段,有望近期获批,用于联合贝伐珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌(HCC)患者。在一项国际IMbrave 150临床研究中,Tecentriq+Avastin作为一线疗法相比索拉非尼显著延长了中国患者的总生存期(未成熟vs11.4个月),使死亡风险降低56%(HR=0.44);同时显著延长了患者PFS(5.7vs3.2个月),疾病恶化风险降低40%(HR=0.60)。该数据与IMbrave 150研究的全球数据一致。
3.嘉和生物英夫利昔单抗申报上市。嘉和生物宣布已向国家药监局提交了英夫利昔单抗生物类似药GB242的上市申请。英夫利西单抗是一种抗TNF-a单抗,由强生原研,已在中国获批多个适应症,包括溃疡性结肠炎、克罗恩病、活动性类风湿关节炎、活动性强直性脊柱炎、斑块型银屑病等等。目前除原研药类克外,中国尚无英夫利西单抗生物类似药获批上市。
4.康方生物PD-1抗体AK105获FDA快速通道资格。康方生物与正大天晴共同开发的PD-1单抗药物派安普利单抗(安尼可,AK105)获FDA授予快速通道资格,用于治疗三线转移性鼻咽癌。这是一款处于临床开发后期的PD-1单抗,此前已在三线治疗鼻咽癌的注册性研究中达到主要终点。目前AK105的临床开发适应症已涉及肝癌、胃癌、肺癌、霍奇金淋巴瘤、鼻咽癌等疾病,其用于治疗至少经过二线系统化疗复发/难治性经典型霍奇金淋巴瘤的新药上市申请已获NMPA受理。
5.亚盛医药1类新药APG-115获批临床。亚盛医药1类新药MDM2-p53抑制剂APG-115获国家药监局临床试验默示许可,将开展联合PD-1/PD-L1抑制剂治疗晚期脂肪肉瘤或其他晚期实体瘤患者的Ⅰb/Ⅱ期临床。其中Ⅰb期为剂量探索阶段,旨在评估APG-115联合PD-1抑制剂(特瑞普利单抗)的安全性和耐受性;Ⅱ期为剂量扩增阶段,并在TP53野生型且MDM2扩增的晚期脂肪肉瘤患者中探索疗效。值得一提的是,APG-115近期刚在美国获得两项孤儿药资格,分别用于治疗急性髓系白血病和胃癌。
6.博雅辑因CRISPR/Cas9基因编辑疗法申报临床。博雅辑因(EdiGene)基因编辑治疗产品ET-01的临床试验申请获国家药监局受理。ET-01是一种CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液,拟开发用于输血依赖型β地中海贫血。根据公开资料,ET-01项目有望通过自体造血干细胞移植为HLA(人类主要组织相容性抗原)配型失败的患者提供新的一次性的治疗方案。


1.辉瑞口服JAK1抑制剂获FDA优先审评资格。FDA受理辉瑞为abrocitinib递交的新药申请并授予其优先审评资格。Abrocitinib是一款口服JAK1抑制剂,用于治疗12岁以上中重度特应性皮炎患者。FDA预计明年4月做出回复。这一申请是基于多项Ⅲ期临床的积极结果,abrocitinib在皮肤症状清除率、疾病严重程度方面显示出统计学显著改善,而且与安慰剂相比,快速改善患者的瘙痒症状。欧洲药品管理局(EMA)也接受了abrocitinib在相同患者人群中的上市申请,预计在2021年下半年做出回复。
2.基因疗法PBGM01获EMA孤儿药认定。欧洲药品管理局(EMA)授予Passage Bio公司用于治疗GM1神经节苷脂贮积症(GM1)的先导基因治疗候选药物PBGM01孤儿药称号。PBGM01是一种AAV基因递送疗法,用于治疗婴儿GM1。PBGM01将编码β-gal的功能性GLB1基因递送至大脑和周围组织,通过减少GM1神经节苷脂的积累,逆转神经元毒性,从而可保护GM1患者的神经功能。FDA已授予PBGM01治疗GM1 的“孤儿药”和“罕见儿科疾病”称号。
3.Revolution公布SHP2+MEK抑制剂最新中期数据。Revolution Medicines在第32届EORTC-NCI-AACR会议上公布了SHP2抑制剂RMC4630联合MEK抑制剂考比替尼针对携带RAS信号通路改变(KRASG12x,KRASamp,NF1LOF,BRAFclass3)肿瘤患者的Ⅰb/Ⅱ期研究最新中期数据。RMC-4630联合考比替尼的药代动力学概况与单药疗法一致;在所测试的所有剂量水平和方案下,暴露量均在导致临床前模型中肿瘤消退的范围内;已在KRASmut大肠癌中观察到初步的抗肿瘤活性证据,7例患者有3例肿瘤减少,包括截止数据时1例未经证实的PR(肿瘤减少范围10%-30%,治疗时间1.9-5.1个月)。
4.礼来终止新冠中和抗体ACTIV-3研究。礼来宣布终止ACTIV-3临床研究,该研究最新数据显示其新冠中和抗体LY-CoV555(bamlanivimab)不太可能改善住院COVID-19患者的后期恢复。该研究由美国过敏和传染病研究所(NIAID)进行。bamlanivimab其他临床研究仍在进行,包括ACTIV-2研究(治疗轻中度COVID-19患者)以及BLAZE-2研究(预防COVID-19的III期临床)。目前,礼来公司已经根据BLAZE-1研究数据向FDA提交了紧急使用授权申请。
5.Exact Sciences欲收购癌症早筛公司Thrive。Exact Sciences拟与Thrive Earlier Detection签订收购Thrive公司的协议。这一收购将结合Thrive的早期筛查检测——CancerSEEK,与Exact Sciences的科学平台、临床组织和商业基础设施,构建基于血液的多癌症筛查领先公司。Thrive的CancerSEEK癌症早筛血检已在包含10000例患者的前瞻性干预性研究中取得了可喜的结果,检测了10种不同类型的癌症,包括7种没有推荐的筛查指南的癌症类型,而且假阳性非常少。


1.国家科技奖由推荐制调整为提名制。国务院总理李克强日前签署国务院令,公布修订后的《国家科学技术奖励条例》,修订后的《条例》共5章38条,自2020年12月1日起施行。《条例》落实科技奖励由推荐制调整为提名制的改革要求。改革报奖方式,实行由专家、学者、组织机构、相关部门等提名的制度,在坚持政府主导的基础上充分发挥专家、学者作用,强化奖励的学术性。
2.2020年度吴阶平医学奖获奖名单公布。10月27日,2020年度吴阶平医学奖评审委员会终审会议在北京欧美同学会召开。经各评委无记名投票,将2020年度吴阶平医学奖授予中国工程院院士、内科血液学专家阮长耿教授,以表彰他在血液学研究领域,所做出的卓越贡献。此外,沈华浩、王洁,马骏、王行环,吉训明等五位教授获得了2020年度吴阶平医药创新奖获奖。
3.北京新发地聚集性疫情病毒来源揭晓。10月23日,清华大学、北京市疾控中心、中国医学科学院病原生物学研究所、北京大学、中国科学院北京基因组研究所联合在《国家科学评论》发文,通过分析相关病例、环境与食品等样品的核酸测序和病毒基因组序列,结合全面的流行病学调查和大数据分析,研究人员揭示,该疫情中病毒源头极有可能是境外疫情高发区的冷链进口食品,并提出,冷链运输或为新冠病毒传播新途径。


【人福医药】全资子公司Epic Pharma, LLC的硫酸苯丙胺片获得美国FDA批准文号。
【科伦药业】公司盐酸莫西沙星氯化钠注射液通过仿制药一致性评价,主要用于治疗敏感菌引起的成人上呼吸道和下呼吸道感染、皮肤和软组织感染及复杂腹腔感染等。
【康龙化成】2020Q1-Q3营收35.86亿元(+36.53%),归母净利润7.89亿元(+140.28%),扣非归母净利润6.06亿元(+85.34%);2020Q3实现营业收入13.93亿元(+40.69%),归母净利润3.10亿元(+85.62%),扣非归母净利润2.44亿元(+43.31%)。


- The End -




 个人中心
个人中心
 我是园区
我是园区




