
责编 | 兮
肿瘤坏死因子(TNF)是一种多效性细胞因子,对维持生理状态下机体抵御病原菌感染、促进细胞存活和组织再生至关重要。然而,如果失调或过度表达,TNF将成为慢性炎症的主要驱动因素之一,且在临床上被视为治疗组织炎症和自身免疫疾病的重要靶点。机体肠道中过量TNF的产生将导致肠上皮细胞死亡增加,并引发肠道炎症,临床上,靶向阻断TNF已为一部分炎症性肠病(IBD)患者提供了有效的治疗。尽管对肠道健康和炎症很重要,但控制肠道中TNF有益或有害作用的机制尚不完全清楚。
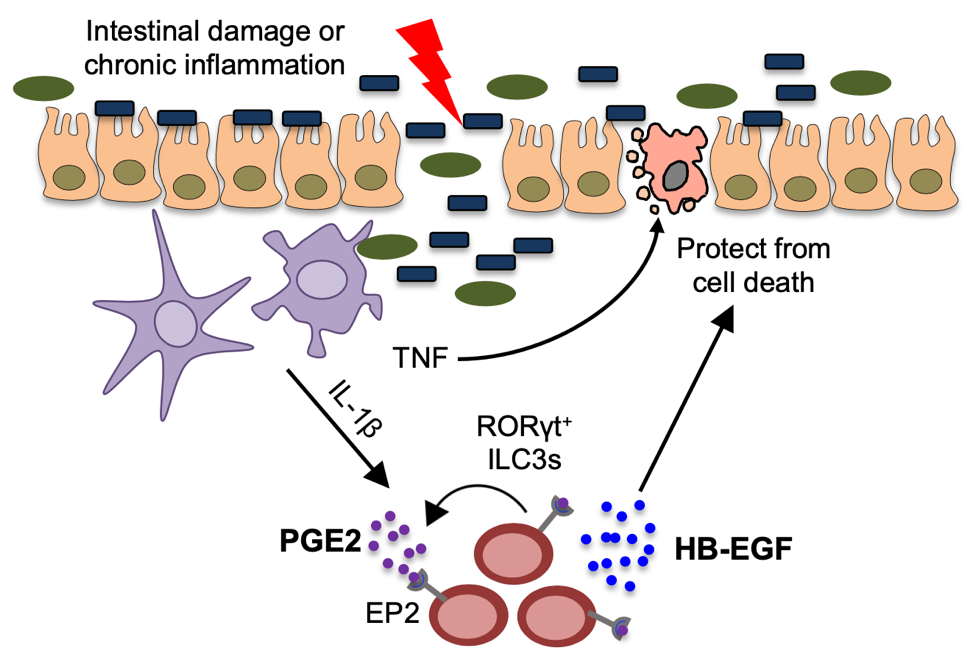
固有淋巴细胞(ILCs)是近年来被发现和定义的一类新型的淋巴样细胞群,它们主要定居在黏膜组织和实质器官内,并对维持组织免疫、炎症和内稳态环境起着重要的作用。根据主要转录因子的表达,ILCs可进一步分为三个亚型,分别为T-bet+ILC1、GATA3+ILC2和RORγt+ILC3。其中,ILC3主要定居于哺乳动物肠道中,对调节肠道内固有和适应性免疫应答、维持肠道免疫耐受、保持肠道屏障完整性及促进组织损伤后修复起着不可或缺的作用。然而,ILC3是否会响应并参与调控TNF诱导的肠道炎症反应并不清楚。
2022年2月1日,美国康奈尔大学Gregory Sonnenberg团队在Nature Immunology杂志上发表研究论文Group 3 innate lymphoid cells produce the growth factor HB-EGF to protect the intestine from TNF-mediated inflammation,揭示了PGE2—ILC3—HB-EGF环路在抑制TNF诱导的组织炎症和促进组织损伤后修复中的重要作用。

利用外源高剂量TNF诱导肠上皮细胞死亡和炎症的小鼠模型,研究人员发现ILC3 对保护肠上皮免受TNF诱导的细胞死亡至关重要且该保护作用不依赖于ILC3产生的IL-22。结合单细胞测序和高通量流式分析,作者们鉴定出一种组织保护性生长因子HB-EGF主要由肠粘膜中的ILC3产生,该生长因子对促进细胞生存、伤口愈合、血管新生和组织修复至关重要。进一步,研究人员阐明了ILC3内源性HB-EGF的产生依赖于前列腺素E2 (PGE2)-EP2信号轴,且通过ILC3感知炎症信号IL-1β并自分泌PGE2的形式完成。特异性敲除小鼠证明ILC3来源的HB-EGF在保护肠上皮免受TNF诱导的细胞死亡,并限制急性和慢性肠道炎症实验模型中起着重要的作用。最后,对临床样本的分析揭示了该通路亦存在于人类ILC3中,且相比于正常肠道组织,IBD样本中HB-EGF+ILC3数量显著降低,暗示了该保护途径在IBD患者中失调。
总的来说,该研究揭示了在机体肠道中一种新型的组织保护机制,即ILC3通过IL-1β信号感知组织损伤和炎症,继而通过PGE2—EP2—HB-EGF信号轴来保护肠上皮免受TNF诱导的细胞死亡,从而限制肠道急性或慢性炎症的发生发展,这将提高我们对肠道炎症的认识和理解,并为IBD的临床干预和治疗提供新的理论依据和潜在的靶点。
据悉,该研究主要由康奈尔大学医学院Sonnenberg教授团队完成,其中周磊博士为论文的第一作者兼共同通讯作者,周文清博士和朱可可博士亦作出了重要贡献。在该项研究中做出贡献的还有多个科研团队,包括斯坦福大学医学院Katrin Andreasson教授、日本大阪大学Eisuke Mekada教授以及法国巴斯德所Gérard Eberl教授。
原文链接:
https://doi.org/10.1038/s41590-021-01110-0
上海交通大学医学院附属仁济医院周磊研究员招聘副研究员、助理研究员、博士后
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




